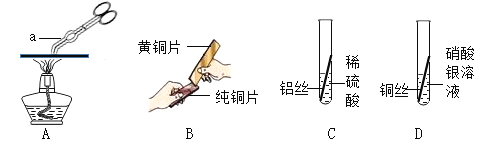
题目内容
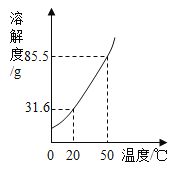
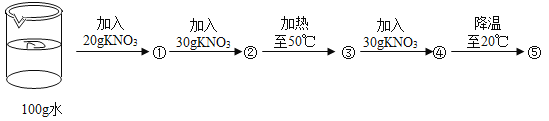
【题目】已知盐酸、硫酸与氢氧化钠、氢氧化钾反应生成的盐的水溶液显中性。现将某蓝色晶体A溶入某一无色中性溶液中,按下图所示过程进行实验:
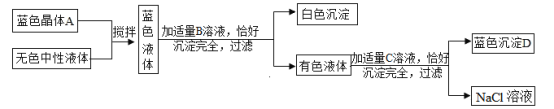
(1)无色中性溶液是含有一种溶质的溶液,则其溶质是_____(填化学式);B溶液中溶质的化学式为_____。
(2)写出有色液体与C溶液反应的化学方程式:_____。
【答案】Na2SO4(或NaCl) BaCl2 CuCl2+2NaOH=Cu(OH)2↓+2NaCl
【解析】
(1)因为实验最后得到的是氯化钠溶液,若无色中性溶液是含有一种溶质的溶液,则根据元素守恒和物质的转化可知,该溶液中的阳离子只能是钠离子,而阴离子可以是硫酸根离子或氯离子,所以溶液中的溶质是:Na2SO4(或NaCl); 因为实验最后得到的是氯化钠溶液和蓝色的氢氧化铜沉淀,所以有色液体是氯化铜溶液,因此B溶液中的阴离子一定只能是氯离子,而蓝色液体和B溶液反应生成白色沉淀,因为蓝色液体中含有铜离子,反应后得到的溶液中含有氯离子,所以白色沉淀不可能是碳酸盐和氯化银,也不可能是碱,只能是硫酸钡(初中阶段一般不考虑硫酸铅),故蓝色溶液中一定含有硫酸铜,B溶液中溶质的化学式为:BaCl2。
(2)根据实验最后得到的是氯化钠溶液和蓝色的氢氧化铜沉淀,可以推出有色液体是氯化铜溶液,C溶液是氢氧化钠溶液,氯化铜溶液和氢氧化钠溶液反应生成氢氧化铜沉淀和氯化钠,反应的化学方程式是:CuCl2+2NaOH=Cu(OH)2↓+2NaCl。

 阅读快车系列答案
阅读快车系列答案【题目】有一种自生氧防毒面具,其使用的生氧剂的主要成分是KO2。某研究小组取100 g生氧剂放入装置A中,加入足量水使之充分反应(4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量。他们进行了三次实验,测定结果如下:
测定序号 | 第1次 | 第2次 | 第3次 | 平均值 |
反应前装置A总质量(g) | 400.1 | 400.2 | 399.7 | 400.0 |
反应后装置A总质量(g) | 376.1 | 376.1 | 375.8 | 376.0 |
请根据上述实验结果计算:(假设杂质不含钾元素且不与水反应)
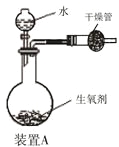
(1)100 g 生氧剂与水反应生成的氧气质量;
(2)生氧剂中含钾元素的质量分数。
【题目】在拓展性课程活动中,小鑫利用以下常见物品验证酸的一些性质。
[实验物品]白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、纯碱。
[查阅资料]牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
[实验探究]
实验序号 | 实验操作 | 实验现象 | 实验结论或解释 |
一 | 将牵牛花汁液滴人白醋中 | 溶液显红色 | 白醋显____(填“酸”“中”或“碱”)性。 |
二 | 将足量的白醋加入放有铁钉的试管中 | 没有看到明显的气泡产生 | / |
三 | 在鸡蛋壳上滴加白醋,将产生的气体通入澄清石灰水中 | 有气泡产生,澄清石灰水变浑浊 | 写出澄清石灰水变浑浊的化学反应方程式:____ |
四 | 向白醋中加入纯碱 | 有气泡冒出 | 白醋能与碱反应 |
[交流与评价]
(1)小鑫对实验二中的现象很疑惑,于是提出猜想:气泡不明显可能与酸的浓度和种类有关。
要验证与酸的浓度有关,应选择下列试剂中的_____________(填字母)。
A 3%的盐酸 B 5%的醋酸 C 5%的盐酸
(2)小鑫想利用pH试纸进一步测定白醋的酸碱度,具体操作方法是____________________。
(3)小露认为实验四不能得到“白醋能与碱反应”的结论,理由是_________________。
[实验验证]小露利用已有物品验证酸与碱的反应,请你帮助完成下列实验设计。
步骤 | 操作 | 现象 |
1 | 将食品干燥剂加入适量清水中,搅拌后静置 | 放出大量的热 |
2 | 取步骤1中的上层清液, | ___________ |
[反思总结]科学来源于生活,生活中的许多事物能更好地帮助我们学习和理解科学。