题目内容
【题目】对比是重要的实验探究方法。
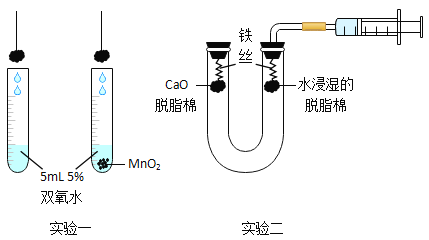
(1)实验一的目的是探究MnO2对双氧水_____;
(2)实验二探究铁生锈的条件,支持O2是生锈必要条件的证据是_____;
(3)查阅资料知:铜在潮湿空气中生锈时发生的反应是: ![]() ,反应的质量比: 128: 32: 44: 18: 222,仿照实验二设计实验三探究铜生锈的条件(试管容积为20mL)
,反应的质量比: 128: 32: 44: 18: 222,仿照实验二设计实验三探究铜生锈的条件(试管容积为20mL)
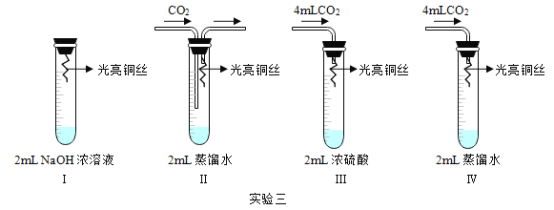
①实验I中NaOH浓溶液的作用是_____(用化学方程式表示)。
②实验Ⅲ试管中控制的量是_____ (填化学式)。
③通过_____(填序号)两个实验对比,得出铜生锈一定与O2有关。
(4) [反思与评价]拉瓦锡用Hg慢慢消耗O2比较准确地测出空气中的O2的体积分数约为五分之一。综合分析实验二、三可知:若将实验二中的铁丝换为足量铜丝,不能达到同样的目的,理由是_____。
【答案】是否有催化作用 左边铁丝不能生锈,右边铁丝生锈 2NaOH+CO2═Na2CO3+H2O H2O Ⅱ、Ⅳ 空气中的二氧化碳气体含量较低,导致氧气不能完全反应
【解析】
(1)实验一的目的是探究MnO2对双氧水是否有催化作用。
故填:是否有催化作用。
(2)实验二探究铁生锈的条件,支持水是生锈必要条件的证据是左边铁丝不能生锈,右边铁丝生锈,这是因为因为左边氧化钙吸收了水蒸气,导致铁丝不能和水接触,右边的铁丝和水充分接触。
故填:左边铁丝不能生锈,右边铁丝生锈。
(3)①实验I中NaOH浓溶液的作用是吸收二氧化碳气体,反应的化学方程式:2NaOH+CO2═Na2CO3+H2O。
故填:2NaOH+CO2═Na2CO3+H2O。
②浓硫酸能够吸收水蒸气,实验Ⅲ试管中控制的量是H2O。
故填:H2O。
③Ⅱ中铜丝和水、二氧化碳接触,没有和氧气接触,不能生锈,Ⅳ中铜丝和水蒸气、二氧化碳气体、氧气同时接触,能够生锈,因此通过Ⅱ、Ⅳ两个实验对比,得出铜生锈一定与O2有关。
故填:Ⅱ、Ⅳ。
(4)拉瓦锡用Hg慢慢消耗O2比较准确地测出空气中的O2的体积分数约为五分之一。综合分析实验二、三可知:若将实验二中的铁丝换为足量铜丝,不能达到同样的目的,理由是空气中的二氧化碳气体含量较低,导致氧气不能完全反应。
故填:空气中的二氧化碳气体含量较低,导致氧气不能完全反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案