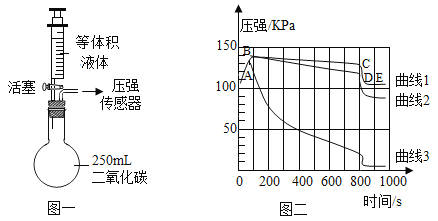
题目内容
【题目】下图是硝酸钾的溶解度曲线。
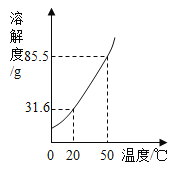
(1)欲将一瓶接近饱和的硝酸钾溶液,在浓度不变的情况下变成饱和溶液,可采取的方法是_____;
(2)小明在20℃时进行了如下实验,得到相应的溶液①~⑤,下列说法正确的是_____。
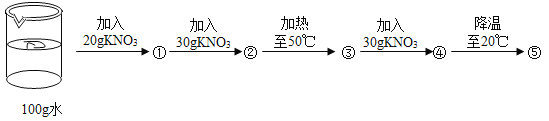
A ④中溶质的质量分数最大 B ②⑤中溶质的质量分数相等
C ①③④中没有固体存在 D ②④⑤的溶液为饱和溶液
【答案】降温 ABC
【解析】
(1)饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。由图可知,硝酸钾的溶解度随温度升高而增大,欲将一瓶接近饱和的硝酸钾溶液,在浓度不变的情况下变成饱和溶液,可采取的方法是降温;
(2)A、在20℃时进行了如下实验,①~⑤的溶液中,溶剂质量相同,④中溶质的质量最大,溶质的质量分数最大,选项正确;
B、20℃时,硝酸钾的溶解度为31.6g,②⑤都是20℃时的饱和溶液,溶质的质量分数相等,选项正确;
C、20℃时,硝酸钾的溶解度为31.6g,①中溶质质量20g能完全溶解,无固体存在;50℃时,硝酸钾的溶解度为85.5g,③中加入固体共50g,能完全溶解,无固体存在;④中加入固体共80g,完全溶解,没有固体存在,选项正确;
D、 50℃时,硝酸钾的溶解度为85.5g,④中只溶解50g,溶液为不饱和溶液,选项错误。
故选ABC。

练习册系列答案
相关题目