题目内容
【题目】用化学方程式表示下列事实
(1)纯净的氢气在空气中燃烧:_____。
(2)服用含氢氧化铝的药物治疗胃酸过多症:_____。
(3)向盛有少量碳酸钠溶液的试管里滴入澄清石灰水:_____。
(4)锻烧石灰石制取生石灰:_____。
(5)实验室用高锰酸钾制备氧气:_____。
【答案】2H2+O2![]() 2H2O Al(OH)3+3HCl═AlCl3+3H2O Na2CO3+Ca(OH)2═CaCO3↓+2NaOH CaCO3
2H2O Al(OH)3+3HCl═AlCl3+3H2O Na2CO3+Ca(OH)2═CaCO3↓+2NaOH CaCO3![]() CaO+CO2↑ 2KMnO4
CaO+CO2↑ 2KMnO4 ![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
【解析】
(1)氢气燃烧生成水,反应的化学方程式:2H2+O2![]() 2H2O。故填:2H2+O2
2H2O。故填:2H2+O2![]() 2H2O。
2H2O。
(2)氢氧化铝和盐酸反应生成氯化铝和水,反应的化学方程式:Al(OH)3+3HCl═AlCl3+3H2O。故填:Al(OH)3+3HCl═AlCl3+3H2O。
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
(4)高温条件下碳酸钙分解生成氧化钙和二氧化碳,反应的化学方程式:CaCO3 ![]() CaO+CO2↑。故填:CaCO3
CaO+CO2↑。故填:CaCO3![]() CaO+CO2↑。
CaO+CO2↑。
(5)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式:2KMnO4 ![]() K2MnO4+MnO2+O2↑。故填:2KMnO4
K2MnO4+MnO2+O2↑。故填:2KMnO4 ![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。

【题目】运用溶解度表与溶解度曲线回答下列问题:
温度/°C | 10 | 30 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
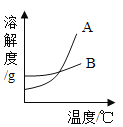
(1)B是 _____________(填“氯化钠”或“硝酸钾”)的溶解度曲线。
(2)60℃时,向100g水中加入100g硝酸钾,所得溶液的溶质质量分数为_____________,当该溶液从60℃降温到30℃时,析出晶体的质量为_____________g。
(3)现有50℃A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是_____(填序号)。
①降低温度 ②升高温度 ③加入A物质