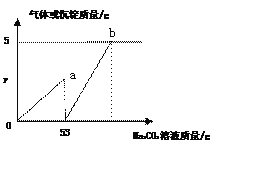
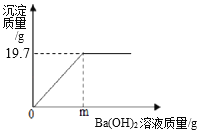
题目内容
【题目】下列是探究灭火原理的四个实验,其中说法不正确的是
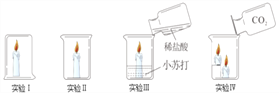
A. 实验Ⅰ中蜡烛熄灭、实验Ⅱ中蜡烛不熄灭,说明隔绝空气可以灭火
B. 实验Ⅲ中蜡烛熄灭,因为稀盐酸与小苏打反应生成二氧化碳使温度降到着火点以下
C. 实验Ⅳ中蜡烛熄灭,说明二氧化碳的密度比空气大且不能燃烧不支持燃烧
D. 通过上述四个实验不能得出灭火的三个原理
【答案】B
【解析】燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;灭火时只需要破坏一个条件即可。A. 实验Ⅰ中烧杯内氧气完全反应后蜡烛熄灭、实验Ⅱ中蜡烛能接触到氧气不熄灭,说明隔绝空气可以灭火,正确;B. 实验Ⅲ中蜡烛熄灭,因为稀盐酸与小苏打反应生成二氧化碳使可燃物与氧气隔绝,蜡烛熄灭,错误;C. 实验Ⅳ中蜡烛由低到高逐渐熄灭,说明二氧化碳的密度比空气大且不能燃烧、不支持燃烧,正确;D. 通过上述四个实验只能能得出隔绝氧气能灭火这1个原理,正确。故选B。

【题目】实验室常用下列装置来制取、收集气体。请回答以下问题。

(1)仪器的名称是:a__________________,b___________________,c__________________。
(2)实验室用KMnO4制取02,应选用的发生装置和收集装置的组合为____________(填字母序号),该发生装置的不足之处是____________________,该反应的化学方程式是________________。
(3)某同学取一定浓度盐酸与石灰石制备二氧化碳,反应方程式为________________________。
将生成的气体通入澄清石灰水中,始终未见浑浊,可能的原因是______________________;
请设计简单的实验进行验证:
实验步骤 | 实验现象 | 实验结论 |
__________________________ | ________________________ | 猜想的可能原因成立 |
(4)常温下块状电石(CaC2)与水反应生成乙炔 (C2H2)气体和氢氧化钙,该反应的化学方程式是_________________________________________,实验室制取乙炔时,须严格控制加水速度,以免剧烈反应放热引起装置炸裂.图中适合制取乙炔气体的发生装置有_________(填装置序号)。