题目内容
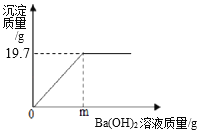
【题目】实验室固体氢氧化钠敞口放置在空气中容易变质而失效,现称取该久置于空气中的烧碱样品12.6g完全溶于蒸馏水中配成119.7g溶液,向其中滴加质量分数为17.1%的氢氧化钡溶液,产生沉淀与所加氢氧化钡溶液的质量关系如图所示。请通过计算回答:
(1)氢氧化钠变质的原因是吸收空气中的二氧化碳生成了碳酸钠,碳酸钠中碳氧元素与氧元素的质量比为:___________________(填最简整数比);
(2)该烧碱样品变质的程度为____________(填“部分变质”或“全部变质”);
(3)m=________ g;
(4)求:当沉淀刚好达到最大质量时,溶液中溶质质量分数_________。(写出计算过程)
【答案】 1:4 部分变质 100 4.7%
【解析】(1)碳酸钠中碳氧元素与氧元素的质量比为:12:(16×3)=1:4
(2)固体氢氧化钠敞口放置在空气中容易变质生成碳酸钠,设样品中碳酸钠的质量为x。
Na2CO3 + Ba(OH)2 == BaCO3↓+ 2NaOH
106 197
x 19.7g
![]() =
=![]() ,解得x=10.6g,则样品中氢氧化钠的质量是:12.6g-10.6g=2g
,解得x=10.6g,则样品中氢氧化钠的质量是:12.6g-10.6g=2g
所以该烧碱样品部分变质。
(3)设生成19.7g碳酸钡沉淀消耗氢氧化钡溶液的质量为y
Na2CO3 + Ba(OH)2 == BaCO3↓+ 2NaOH
171 197
y×17.1% 19.7g
![]() =
=![]() ,解得y=100g
,解得y=100g
(4)设生成19.7g碳酸钡沉淀的同时生成氢氧化钠的质量为w
Na2CO3 + Ba(OH)2 == BaCO3↓+ 2NaOH
197 80
19.7g w
![]() =
=![]() ,解得w=8g
,解得w=8g
当沉淀刚好达到最大质量时,溶液中溶质质量为:8g+2g=10g
当沉淀刚好达到最大质量时,溶液的质量为:12.6g+119.7g+100g-19.7g=212.6g
当沉淀刚好达到最大质量时,溶液中溶质质量分数为:![]() ×100%=4.7%
×100%=4.7%