��Ŀ����
ijͬѧΪ�ⶨ12g�����ʵ���������Ʒ������������������������ϡ�����п����ȡ�������������ͼ��ʾ��װ�ã������йص�ʵ��̽������ʾ��3H2+Fe2O3 2Fe+3H2O���ʲ��μӷ�Ӧ���ٶ�ÿ������ȫ��Ӧ�����գ�����ش��й����⣺
2Fe+3H2O���ʲ��μӷ�Ӧ���ٶ�ÿ������ȫ��Ӧ�����գ�����ش��й����⣺
�õ��������ݣ�
| װ�� | B | C |
| ��Ӧǰ���� | 86.3g | 284.2g |
| ��Ӧ������ | 83.9g | 286.9g |
��1���������Ʒ����������������������д�����㲽�裬��������ȷ��0��l%��
��2����ʵ�黹�ɲⶨ���ˮ�ĸ�Ԫ��֮���������ϵ�����ñ���ʵ��������ʽ��ʾ��ˮ���⡢��Ԫ�ص�������Ϊ�� �������û������������е�������û����ȫ��Ӧ�������ˮ���⡢��Ԫ�ص������Ȼ� ����ѡ�ƫ����ƫС�����䡱����
��1����Ʒ������������������Ϊ66.7%��
��2��[��286.9g��284.2g������86.3g��83.9g��]����86.3g��83.9g�������䡣
���������������1��Cװ��ΪŨ���ᣬ���շ�Ӧ���ɵ�ˮ����Cװ�����ӵ������������ɵ�ˮ��������Ȼ����ݻ�ѧ����ʽ������ˮ�����������������������Ȼ����������������������.
����ˮ������Ϊ286.9g��284.2g=2.7g
����Ʒ��������������ΪX
3H2+Fe2O3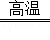 2Fe+3H2O
2Fe+3H2O
160 3��18
x 2.7g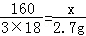 x=8g
x=8g
����Ʒ������������������Ϊ��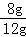 ��100%��66.7%
��100%��66.7%
��2������Bװ���м��ٵ�����Ϊ��Ԫ�ص���������86.3g��83.9g���ָ���Cװ�������ӵ�����Ϊˮ��������ˮ����Ԫ�غ���Ԫ����ɣ���ˮ��������ȥ��Ԫ�ص�����������Ԫ�ص�����������286.9g��284.2g������86.3g��83.9g��������Ԫ�غ���Ԫ�ص�������Ϊ������286.9g��284.2g������86.3g��83.9g��������86.3g��83.9g������Ϊ���ʵ������һ���ģ�ˮ������Ԫ�ص���������һ���ģ��ʼ�ʹ�������е�������û����ȫ��Ӧ��ˮ������Ԫ�ص��������Dz���ġ�
���㣺���⿼����ݻ�ѧ��Ӧ����ʽ�ļ��㡣

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д������ҿ����գ�С����С�ѡ�С����С����ͬѧ����ʵ���ң�����ʵ�����ϰڷ�����ƿ�ޱ�ǩ���Լ����ֱ�����ƿ�������ƿҺ�壬ͬѧ�Ǿ����ԡ�������Һ�塱֮��ķ�Ӧ����һϵ��̽����
��1��С��ͬѧ��һƿ�����һƿҺ���и�ȡ�����Լ����Թ��н��л�ϣ�����������һ����ɫ���壬�������Ǻ����ʣ�ͬѧ�ǽ����˴IJ��룬С��ͬѧ��
��������Ǣ��� �������� ��������
��2���������һ��ʵ��֤��С��ͬѧ���������ȷ�ģ�ʵ��������£�
| ʵ�鲽�� | ������ |
| ���� | ���� |
��3��С��������ͼ�������ռ�װ���ռ�һƿС��ͬѧ������е����壬���������� ������a��b���˽��룮

��4��С��ͬѧ��������ƿ�Լ��и�ȡ�����Լ����Թ��У����ֻ�Ϻ��巢���˱仯���������ݷų���ͬѧ�ǶԼ����Թ��еĹ����Һ��Ӳ�ͬ�ķ�Ӧ���͡��������ȷ�������˴IJ��룺
����һ���� ����
��������� ����
���������� ����
ʵ������ijС������̽��һ�����⣮������Ʒ�����СӢ���Թ��м���2mL����������Һ�����뼸�η�̪��Һ����Һ�Ժ�ɫ��Ȼ�������õι���������һ������ϡ���ᣬ��Һ�ɺ�ɫ��Ϊ��ɫ��
��1������̽���������������������
��̪��Һ���ᡢ����Һ����ʾ��ͬ��ɫ�𣿢���ͼ���Һ�ܷ�����Ӧ��
��2����Ҷ�СӢ�õ�����ɫ��Һ����̽����
С����Ϊ��Ӧ����Һ�е������������ƣ�С����Ϊ���������֣��������� ����
ͬѧ�Ǹ����������ַ�������ʵ���һ����ΪС���Ĺ۵�����ȷ�ģ����㲹���±��Ŀ�ȱ��
| ʵ����� | ʵ������ | ʵ����� |
| ����һ��ȡ������Ӧ�����Һ�����Թ��У������м����� �� | �� �� | С���Ĺ۵���ȷ |
| ��������ȡ������Ӧ�����Һ�����Թ��У������м����� �� | �� �� |
��3�������ȫ��ͬѧһ������������⣮

��ϡ���������������Һ������Ӧ���۹�����ͼ1��ʾ�������ӵĽǶȾ�������÷�Ӧ�ܷ�����ԭ������ ����
��п������ͭ��Һ������Ӧ���۹�����ͼ2��ʾ�������ӵĽǶȾ�������ñ仯�ǻ�ѧ�仯��ԭ������ ����
��ͨ�����Ϸ�������ʾ����ѧ��Ӧ���۱������� ����
��ʦ�뻯ѧ��ȤС���ͬѧ��������ʧȥ��ǩ��̼���ơ�ϡ���ᡢ�Ȼ��ơ��������ƺ��Ȼ�����Һ����������������ñ�ǩ��Ϊ��������������Һ�����Լ�ƿ���ΪA��B��C��D��E����С��ͬѧ����������̽����
| | ʵ�鲽�� | ʵ������ | ʵ����� |
| ����һ |  | B��C��Һ���ֺ�ɫ A��D��E��Һ��ɫ�����Ա仯 | B��C��Һ���� ���� |
| ����� |  | B��C��Һ��ɫ����ʧ�� ��C��Һ�в����������� | ��ȷ��BΪ �� ����Һ��A��C�ķ�Ӧͨ�� ������ʵ������ȡ����� ԭ���� �� �� |
| ������ |  �� �� | E������������ D�е�����Ϊ �� �� | ȷ��EΪ�Ȼ�����Һ�� ��D��Һ�������Լ�������Ӧ�Ļ�ѧ����ʽΪ �� �� |
ij�ѧʵ��ν�������ε�����ʵ�顣
���������ָʾ����
��1��ȡ�����ϰ��˺Ͱײ�Ҷ�����ֱ�����в��е��ã�����ƾ����ݣ���ɴ�������ݳ���֭Һ�������ֱ�װ�ô��á�
��2��ȡ��֧�Թֱܷ���NaOH��Һ��ϡ�������ʵ�飬�۲쵽������ͼ����¼���£�
| | NaOH��Һ | ϡ���� | ƻ��֭ |
| �ϰ���֭Һ | ����ɫ | �ں�ɫ | ��ɫ |
| �ײ�֭Һ | ����ɫ | �ܵ���ɫ | ����ɫ |
����Ϊ����֭Һ�У����ʺ������ָʾ�������� ����
��3������ƻ��֭������ͬʵ�飬�����¼���ϱ�����ƻ��֭��Һ���� ���ԡ�
������ε����ʡ�
��һ��ѧ������CuSO4��NaOH��Һ�ķ�Ӧ���۲쵽���������� ����
�ڶ���ѧ������BaCl2��Na2CO3��Һ�ķ�Ӧ����Ӧ�ķ���ʽΪ�� ����
�Ӹ��ֽⷴӦ�������۱����Ͽ����кͷ�Ӧ��ʵ�ʿ�������ͼ1��ʾ����ô����ͼ2����н�CuSO4��NaOH��Һ�ķ�Ӧ����ʾ��ͼ����������
����Һ��̽����
ʵ�����������ͬѧ��ȫ������Һ���е���һ����Һ���У���ѧ��ȤС�����Һ���й��ˣ��õ���ɫ��Һ����һ��̽����ɫ��Һ�ijɷ֡�
��������⡿��Һ�����ʳ���NaCl�⣬����ʲô���ʣ�
��������롿����٣�BaCl2������ڣ�Na2SO4������ۣ�NaOH������ܣ�BaCl2��NaOH�����룺��Na2CO3��Na2SO4�����룺��Na2SO4��NaOH�����룺��Na2CO3��Na2SO4���� ����
��ʵ��̽����
��1��ȡ�����μ��ϰ���Ҷ֭������ɫ��С���ж�һ����NaOH��С����ͬ�⣬�������� ������2��ȡ��������������ϡ���ᣬ����������������� ��һ����������
��3��Ϊȷ������Һ����ɣ����貹���ʵ���ǣ��� �������۲쵽��ɫ�����������ɫ��Һ��������� ����
������ij�о�С��̽��Ӱ�췴Ӧ���ʲ������ص����ʵ�����ݣ�
| ʵ����� | ����������ҺŨ�ȡ�% | ����������Һ���/ml | �¶�/C | �������̵�����/g | �ռ����������/ml | ��Ӧ�����ʱ��/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.74 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | | 2 | 49.21 |
| 4 | 30 | 5 | 55 | | 2 | 10.76 |
��1��ͨ��ʵ��ٺ͢ڶԱȿ�֪����ѧ��Ӧ�������� ���йأ���ʵ��ۺܶ͢Աȿ�֪����ѧ��Ӧ�������¶ȵĹ�ϵ���� ����
��2����ѧ��Ӧ��ʵ������������Ӵ�����ײ�Ľ������ѧ��Ӧ�����������ӵĸ����йأ��Դ��۽ǶȽ��͡���Ӧ��Ũ��Խ��ѧ��Ӧ����Խ�족��ԭ������
��3����һ����15%�Ĺ���������Һ��������Ϊ�˼�С��Ӧ���ʣ��ɼ�������ˮϡ�ͣ������������������� ����ѡ���С�����䡱��������



