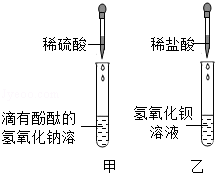
题目内容
以下是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验序号 | 过氧化氢溶液浓度、% | 过氧化氢溶液体积/ml | 温度/C | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.74 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | | 2 | 49.21 |
| 4 | 30 | 5 | 55 | | 2 | 10.76 |
(1)通过实验①和②对比可知,化学反应速率与 有关;从实验③和④对比可知,化学反应速率与温度的关系是 ;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量 (选填“减小”或“不变”或“增大”).
(1)反应物浓度(或浓度);温度越高,化学反应速率越快.(2)反应物浓度越大,单位体积的反应物中含有的粒子数越多,粒子间碰撞的概率越大,化学反应速率越快(3)不变
解析试题分析:(1)从表中分析可知:①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系;③④则是温度不同其他条件相同,明显是对温度影响化学反应速度的探究;(2)反应物浓度大时溶液中的离子数量较多,反应的接触面较大反应速度自然变快;(3)过氧化氢的浓度虽然改变,但过氧化氢的量并未增减,因此生成氧气的量不变
考点:影响化学反应速率的因素探究

 综合自测系列答案
综合自测系列答案某化学小组测定空气中氧气的体积分数。
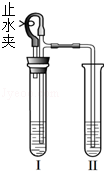
(1)根据右图回答问题。
①红磷燃烧的化学方程式为 。
②若将红磷改为木炭,反应结束后降至室温,打开止水夹,烧杯中的水不倒吸入集气瓶的原因是 _。
(2)用四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数。
反应原理为:2Na2S4+O2+2H2O=8S↓+4NaOH(氢氧化钠)。
小资料:四硫化钠(Na2S4)与氧气、水反应生成难溶于水的固体硫(S)和易溶于水
的氢氧化钠。
【实验过程】
①取足量的四硫化钠固体加入试管中,再加入适量的水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图1所示)。
图1 图2
②将该试管插入水中(如图2所示),拔下橡胶塞,观察到 ,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离,记录数据h2。理论上h2∶h1= 。
③按照①和②再重复实验2次。3次实验数据如下表所示。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
根据第3次实验数据,计算空气中氧气的体积分数为 %(结果精确到 0.1%)。
某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
得到如下数据:
| 装置 | B | C |
| 反应前质量 | 86.3g | 284.2g |
| 反应后质量 | 83.9g | 286.9g |
(1)请计算样品中氧化铁的质量分数.(写出计算步骤,计算结果精确到0.l%)
(2)该实验还可测定组成水的各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为 (不用化简);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会 (选填“偏大”、“偏小”或“不变”).
为了解环境因素对维生素C含量的影响,从而更好地保存有关食物,某兴趣小组同学根据维生素C可使高锰酸钾(KMn04;)溶液褪色的原理,进行了如下表所示的实验。
| 编号 | 维生素C溶液的处理方法 | 使40毫升KMn04溶液褪色的平均滴数 |
| 1 | 放置于室内暗处0.5小时 | 15 |
| 2 | 强烈阳光直射5小时后,放置于室内暗处0.5小时 | 22 |
| 3 | 煮沸l0分钟后,放置于室内暗处0.5小时 | 21 |
(1)他们探究了_______ ____对维生素C含量的影响;
(2)他们的探究对我们启示是:在贮存富含维生素C的食物时,应________________,以防止其中的维生素C过量流失,降低食物的营养价值;
(3)为了解维生素C的化学性质,他们用pH试纸测得该维生素C溶液的pH在1至2之间,说明维生素C具有________性。