题目内容
如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
(1)为测定室温下Na2CO3的溶解度,在编号为A、B、C、D的四个烧杯中各加入室温下的水100g,并分别加入取自实验室的Na2CO3固体,搅拌至充分溶解,实验数据记录如表:
| 烧杯编号 | A | B | C | D |
| 水的质量/克 | 100 | 100 | 100 | 100 |
| 加入Na2CO3的质量/克 | 30 | 35 | 40 | 50 |
| 溶液的质量/克 | 130 | 135 | 140 | 140 |
(2)为确定食用纯碱的纯度,称取自带的食用纯碱5.4g放入烧杯中,再滴加盐酸至刚好完全反应,共用去稀盐酸25g,得溶质质量为28.2g(杂质溶于水且与盐酸不反应),通过计算判断该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符.(计算结果精确到0.1%)
(1)40g (2)该食用纯碱中碳酸钠的质量分数与包装袋信息相符.
解析试题分析:(1)由实验数据可知室温下的水100g最多溶解40g碳酸钠,所以烧杯编号为C、D中的溶液是饱和溶液,室温下,Na2CO3的溶解度是40g;
(2)设食用纯碱中碳酸钠的质量分数为x.
二氧化碳的质量=5.4g+25g-28.2g=2.2g
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
5.4g×x 2.2g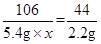
x=98.1%
98.1%>98%
所以与包装袋信息相符
答:该食用纯碱中碳酸钠的质量分数与包装袋信息相符.
考点:固体溶解度的概念;饱和溶液和不饱和溶液;根据化学反应方程式的计算.
点评:本题考查饱和溶液的判断和溶解度的简单计算,学生利用在该条件下有固体不能继续溶解来判断是否为饱和溶液是解答的关键.

一瓶久置的氢氧化钠固体已经发生了变质,某研究小组为了探究氢氧化钠的变质纯度,作出如下猜想:猜想一、可能部分变质,固体是NaOH和Na2CO3的混合物;猜想二、可能全部变质,固体是Na2CO3。
(1)首先对固体的成分进行确定。取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层溶液,再加入CuSO4溶液,产生蓝色絮状沉淀。根据实验现象,可判断 是正确的。
(2)称取10.6克该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
计算该样品中Na2CO3的质量分数。
(3)请你分析,一定质量的NaOH固体,变质前后与足量的稀盐酸反应,变质前生成NaCl
的量 (填“大于”、“等于”、或“小于”)变质后生成NaCl的量。
如图是某同学设计的实验装置,用于实验室制取气体和实验探究.下列说法正确的是( )
| A.仪器a是长颈漏斗 |
| B.仪器b在实验中可直接加热 |
| C.此装置可用于高锰酸钾制取氧气 |
| D.此装置可制取、收集、检验二氧化碳 |