题目内容
某纯碱样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11g,加入到盛有50g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g.计算:
(1)纯碱样品中碳酸钠的质量分数;
(2)反应后所得溶液的溶质质量分数.
(1)96.4% (2)21.4%
解析试题分析:(1)生成二氧化碳的质量为11g+50g﹣56.6g=4.4g
设样品中碳酸钠的质量为x,生成的氯化钠是y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4g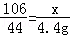
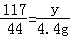
解得,x=10.6g y=11.7g
碳酸钠的质量分数=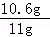 ×100%≈96.4%
×100%≈96.4%
(2)所得溶液中NaCl的质量为原样品中氯化钠的质量与生成氯化钠的质量之和.
氯化钠的质量=11.7g+(11g﹣10.6g)=12.1g
溶液的质量=56.6g
所得溶液的溶质质量分数=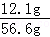 ×100%≈21.4%
×100%≈21.4%
答 (1)样品中碳酸钠的质量分数为96.4%
(2)反应后所得溶液中溶质的质量分数21.4%
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.

练习册系列答案
相关题目