题目内容
【题目】将50g硝酸钾放入盛有50g水的烧杯中充分溶解,如图是溶液质量随温度变化的曲线。
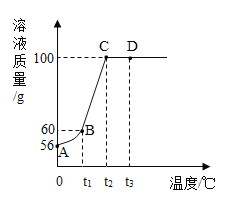
则t1°C时硝酸钾的溶解度为____g;在A、B、C、D4个点对应的溶液中___点的溶液一定是饱和溶液;向40gD点的溶液中加入10g水,所得溶液的溶质质量分数为____。
【答案】20g ABC(选对2个就可得1分) 40%
【解析】
将50g硝酸钾放入盛有50g水的烧杯中充分溶解,如图可知,t1℃时,溶液的质量为60g,即该温度下,50g水最多能溶解10g硝酸钾,故100g水最多能溶解20g硝酸钾,故t1℃时硝酸钾的溶解度为20g;
由图可知,将50g硝酸钾放入盛有50g水的烧杯中充分溶解,一开始,随着温度的升高,硝酸钾溶液的质量逐渐增加,说明一开始,溶质未全部溶解,随着温度的升高,溶解度增加,溶质不断溶解,到C点时,溶液质量不再变化,说明C点时,50g硝酸钾恰好溶解到50g水中,溶液恰好达到饱和,之后溶液质量不再变化,是不饱和溶液,故在A、B、C、D4个点对应的溶液中A、B、C点的溶液一定是饱和溶液;
由图可知,D点溶液的溶质质量分数为:![]() ,故40gD点溶液的溶质质量为:40g×50%=20g;故向40gD点的溶液中加入10g水,所得溶液的溶质质量分数为:
,故40gD点溶液的溶质质量为:40g×50%=20g;故向40gD点的溶液中加入10g水,所得溶液的溶质质量分数为:![]() 。
。

【题目】自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。
①金属镁的物理性质:__________(写一条);
②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为___________。
(2)第二站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤溶液中提取镁,流程如下:

流程中操作a为_________,步骤中Mg(OH)2与加入的X发生中和反应,请写出相关的化学方程式______。
(3)第三站:再探金属镁。
(提出问题)镁能否与热水反应 ? 如果反应,产物是什么?
(相关信息)①Mg+2H2O=Mg(OH)2+H2↑②氢氧化镁在热水中能部分溶解,液体呈碱性。
实验操作 | 实验现象 | 实验结论 |
①将打磨好的镁条放入盛有热水的试管中,收集气体并将气体点燃; | ①气体能被点燃,产生淡蓝色的火焰; | 镁能与热水反应,生成氢氧化镁和氢气 |
②反应后向试管中滴入酚酞试液 | ②________ |