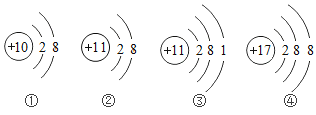
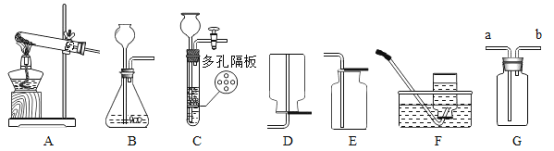
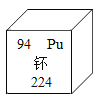
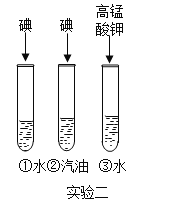
题目内容
【题目】CaCO3高温加热可以生成CaO和CO2气体,现取一定质量的CaCO3高温加热一段时间,冷却,测得剩余固体的质量为8.0克,剩余固体中钙元素的质量分数为50%。下列判断正确的是
A.生成2.0克的CO2
B.原来CaCO3为14.2克
C.生成了5.6克的CaO
D.剩余CaCO3的质量为3.0克
【答案】A
【解析】
根据题意可以知道钙元素的质量为:8.0g×50.0%=4.0g,所以反应前碳酸钙的质量为:4.0g÷![]() ×100%=10.0g,
×100%=10.0g,
根据质量守恒定律可以知道生成二氧化碳的质量为:10.0g-8.0g=2.0g;
设生成氧化钙的质量为x,消耗碳酸钙的质量为y
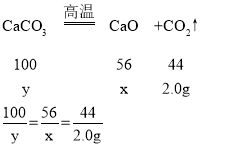
解得:x=2.55g;y=4.55g
A、根据质量守恒定律可以知道生成二氧化碳的质量为:10.0g-8.0g=2.0g;故正确;
B、根据上述分析可以知道原来碳酸钙的质量为10.0g,故错误;
C、根据计算可以知道生成氧化钙的质量2.55g,故错误;
D、根据计算可以知道剩余的碳酸钙的质量为10.0g-4.55g=5.44g,故错误。
故选:A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目