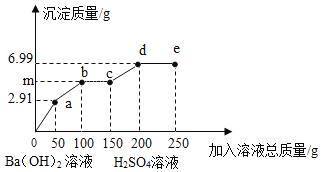
题目内容
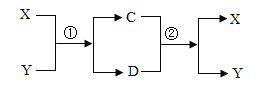
【题目】将CuSO4和Na2SO4的固体混合物进行分离主要流程如下:

(1)加试剂A的目的是将CuSO4转化为沉淀。试剂A可以选择______溶液(填序号)。
aNaOH bCa(OH)2cBaCl2
(2)操作1所用玻璃仪器有______、玻璃棒、烧杯。
(3)判断溶液2中所加稀硫酸为适量的方法是______(填序号)。
a溶液2中预先滴入石蕊 b加入稀硫酸时用传感器测溶液pH
(4)确认固体被洗净的操作是:向最后一次洗涤后的滤液中滴入______溶液,无现象。
【答案】a 漏斗 b BaCl2
【解析】
(1)a、氢氧化钠能与硫酸铜反应生成氢氧化铜和硫酸钠,后面,加适量稀硫酸,过量的氢氧化钠能与稀硫酸反应生成硫酸钠和水,能将氢氧化铜转化为沉淀,且没有引入新的杂质,符合题意;
b、氢氧化钙能与硫酸铜反应生成氢氧化铜和硫酸钙,引入了新的杂质硫酸钙,不符合题意;
c、氯化钡能与硫酸铜反应生成硫酸钡沉淀和氯化铜,不能达到分离硫酸钠和硫酸铜的目的,不符合题意。
故选a;
(2)由图可知,操作1实现了固液分离,故操作1是过滤,过滤所用的玻璃仪器有:烧杯、漏斗、玻璃棒;
(3)由以上分析可知,过量的试剂A为氢氧化钠,故溶液2中含有氢氧化钠,加入适量的稀硫酸,是为了中和氢氧化钠,判断溶液2中所加稀硫酸为适量的方法:
a、溶液2中预先滴入石蕊,氢氧化钠显碱性,能使紫色石蕊试液变蓝,随着稀硫酸的加入,氢氧化钠与稀硫酸反应生成硫酸钠和水,硫酸钠显中性,不能使紫色石蕊试液变色,当恰好完全反应时,溶液变为紫色,可以判断所加硫酸适量,但是该步骤是为了得到硫酸钠,石蕊的颜色变化界限不明显,而且加入石蕊试剂,会引入杂质,不符合题意;
b、氢氧化钠显碱性,pH>7,滴入稀硫酸,氢氧化钠与稀硫酸反应生成硫酸钠和水,当恰好完全反应时,溶液显中性,pH=7,故加入稀硫酸时用传感器测溶液pH,可以判断溶液2中所加稀硫酸为适量,且没有引入新的杂质,符合题意。
故选b;
(4)固体混合物为硫酸铜和硫酸钠,加水溶解,加入过量氢氧化钠,硫酸铜与氢氧化钠反应生成氢氧化铜和硫酸钠,如果固体未洗净,会残留有硫酸钠,故可加入氯化钡溶液,氯化钡能与硫酸钠反应生成硫酸钡沉淀,如果出现白色沉淀,则说明没有洗净,如果无现象,说明已经洗净,故填:BaCl2。

 期末集结号系列答案
期末集结号系列答案【题目】化学与生活密切相关。
(1)每100g巧克力中部分营养成分的含量如表。
蛋白质/g | 脂肪/g | 糖类/g | 矿物质/mg | 总能量/千焦 | ||
钙 | 铁 | 磷 | ||||
5 | 32 | 51 | 50 | 4 | 120 | 2142 |
食物中主要的营养成分表中未列出的重要有机物是_____,2142千焦能量全部来自糖类吗?_____(填“是”或“不是”)。
(2)塑料袋曾给人们的生活带来很大方便,如今却被称为“人类最糟糕的发明”。我国每天消耗约10亿只塑料袋。国务院发出通知限制生产和使用塑料购物袋。请回答下列问题:
①聚乙烯塑料是一种含碳燃料,完全燃烧产生二氧化碳和水;当氧气不充足时,含碳燃料中的部分碳、氢元素还可以生成_____(填序号)。
A 一氧化碳
B 碳氢化合物等有毒气体
C 炭黑
②鉴别聚乙烯和聚氯乙烯的操作方法是:_____。
(3)水是生命之源。请回答下列问题:
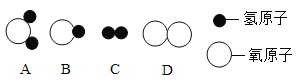
①构成水的微粒可表示为_____(填图中序号);
②硬水是指含有较多_____(填离子符号)的水。生活中,可用_____鉴别硬水和软水;
③下图为电解水的实验装置图,下列说法正确的是_____(填序号)。
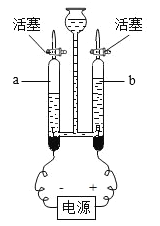
A 在水中加入少量稀硫酸以增强水的导电性
B 与正极相连的玻璃管内得到的气体能使带火星的木条复燃
C 该实验中所得氢气和氧气的质量比约为2:1
D 根据该实验所得产物,说明水分子可分