��Ŀ����
��������ɽˮ�೧����ʡ��ģ�ϴ��ˮ�೧���ó��Ļ�����Ϊ�˲ⶨij��ɽʯ��ʯ��̼��Ƶ�����������ȡʯ��ʯ��Ʒ��������10%��ϡ�������ձ��з�Ӧ������ʯ��ʯ��Ʒ�����ʲ���ϡ���ᷴӦҲ������ˮ�����й�ʵ���������±���
| | ��Ӧǰ | ��Ӧ�� | |
| ʵ������ | �ձ���ϡ��������� | ʯ��ʯ��Ʒ������ | �ձ������л��������� |
| 134.4g | 10g | 141.1g |
��1����ʯ��ʯ��̼��Ƶ�����������
��2��������10%�������������
��1��75% ��2��54.75g
���������������1�����������غ㶨�ɣ�������̼������Ϊ��134.4g+10g��141.1g=3.3g
���ʯ��ʯ��Ʒ��̼��Ƶ�����Ϊx�����ĵ��������ʵ�����Ϊy
CaCO3+2HCl=CaCl2+H2O+CO2��
100 73 44
x y 3.3g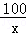 =
=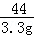 x=7.5g
x=7.5g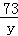 =
=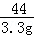 y=5.475g
y=5.475g
��ʯ��ʯ��̼��Ƶ���������Ϊ��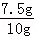 ��100%=75%
��100%=75%
��2�������ĵ�10%�������������5.475g��10%=54.75g
�𣺸�ʯ��ʯ��̼��Ƶ���������Ϊ75%��������10%�������������54.75g��
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ��㣮
���������������û�ѧ�еĻ���˼�������غ�˼�룬ͨ�����������Ļ�ѧ��Ӧԭ����֪���ɵĶ�����̼�������������з���ʽ���㣬�Ӷ�������ѧ���ķ�������������������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�ij����С����������ŷŵķ�ˮ�к���������Ȼ�þ������Ⱦ�Ϊ�ⶨ�÷�ˮ�и���Ⱦ��ĺ���������С�����������ʵ�飺
��ʵ��һ��ȡ��ˮ100g�������м���������������Ϊ10%������������Һ����ó�������������������������Һ�����Ĺ�ϵ��ͼ�������ʵ�鼰�й����ݷ����ͼ��㣺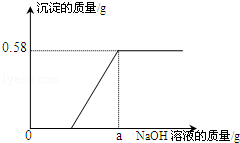
��1����100g�÷�ˮ�м�������������������Һʱ�������ij�������Ϊ g��
��2����÷�ˮ���Ȼ�þ���ʵ����������Ƕ��٣�
��ʵ�����ȡ���ݷ�ˮ��100g���ֱ������뵽20g��40g��60gij��������Һ�У��������ʵ�����ݼ��±���
| | ��һ�� | �ڶ��� | ������ |
| ��������Һ������/g | 20 | 40 | 60 |
| ���ɳ���������/s | 2.870 | 5.740 | 7.175 |
��3��100g��ˮ�м�����������Һ������Ϊ gʱ����ǡ����ȫ��Ӧ��
��4����ʵ��һ��ͼʾ�У�a����ֵΪ ��