题目内容
某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实验室现有的是溶质质量分数为98%的浓硫酸。试计算:
(1)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?
(2)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?
(反应的化学方程式为Zn+H2SO4 = ZnSO4+H2↑)
(1)解:设加水后溶液的质量为x
10g ×98%= x×19.6% (1分)
x =50g (1分)
需要水的质量=50g一l0g =40g (1分)
(2)解:设生成氢气的质量为x
Zn+H2SO4=ZnSO4 + H2↑ (1分)
98 2
20g×19.6% x (1分)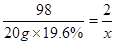 (1分)
(1分)
x ="0." 08g (2分)
解析试题分析:(1)溶液稀释的计算根据稀释前后溶液中溶质的质量不变列式;先计算出稀释后溶液的质量,再用溶液的质量减去稀释前溶液的质量;(2)先计算出20g49.6%的硫酸中硫酸的质量,再利用化学方程式,可求出氢气的质量。
考点:溶液的计算、化学方程式的计算

甘肃祁连山水泥厂是我省规模较大的水泥厂,该厂的化验室为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表:
| | 反应前 | 反应后 | |
| 实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4g | 10g | 141.1g |
(1)该石灰石中碳酸钙的质量分数;
(2)所消耗10%的盐酸的质量.
工业上侯氏制碱法得到的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验.在实验室中取27g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表:
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是 g.
(2)计算纯碱样品中碳酸钠的质量分数是多少?(计算结果精确到0.1%)
(3)计算所用稀盐酸的质量分数是多少?
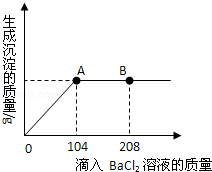
小黄同学为了测定某混合物(Na2CO3与NaOH混合)中碳酸钠的质量分数,进行了如下实验:称取了20g样品配成溶液,然后逐渐加入一定量质量分数为20.8%的BaCl2溶液(已知:Na2CO3+BaCl2=2NaCl+BaCO3↓),充分反应.在此过程中他进行了三次数据测定,结果如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 |
| 加入BaCl2溶液的质量/g | 60 | 120 | 150 |
| 生成沉淀的质量/g | 11.82 | 19.7 | 19.7 |
(1)第一次测定数据后所得溶液中含有溶质是NaOH, (填化学式);
(2)此实验中,实际参加反应的BaCl2溶液的质量为 ;
(3)样品中碳酸钠的质量分数为多少?(写出计算过程)