题目内容
“侯氏制碱法”制得的纯碱中含有少量氯化钠.取NaCl和Na2CO3的固体混合物25克溶于适量的蒸馏水中,滴入稀盐酸至恰好完全反应,得到10%的NaCl溶液272克.
(化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑)
求:(1)反应后所得溶液中溶质的质量.
(2)原固体混合物中NaCl的质量分数.
(1)27.2g (2)15.2%
解析试题分析:(1)反应后所得溶液中NaCl的质量为272g×10%=27.2g;
(2)原混合物的质量是25g,而反应后固体的质量——氯化钠为27.2g,固体质量增加是因为碳酸钠和盐酸反应变为氯化钠,可据差量法计算,
设原固体混合物中Na2CO3的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑ 固体质量增加
106 117 117﹣106=11
x 27.2g﹣25g=2.2g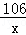 =
=
x=21.2g
所以原固体混合物中NaCl的质量为:25g﹣21.2g=3.8g
则混合物中NaCl的质量分数为 ×100%=15.2%
×100%=15.2%
答:反应后所得溶液中溶质的质量是27.2g;
原固体混合物中NaCl的质量分数是15.2%.
考点:根据化学反应方程式的计算.
点评:明确发生化学反应的原理,生成物中氯化钠的来源,结合方程式即可顺利解答.

甘肃祁连山水泥厂是我省规模较大的水泥厂,该厂的化验室为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表:
| | 反应前 | 反应后 | |
| 实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4g | 10g | 141.1g |
(1)该石灰石中碳酸钙的质量分数;
(2)所消耗10%的盐酸的质量.
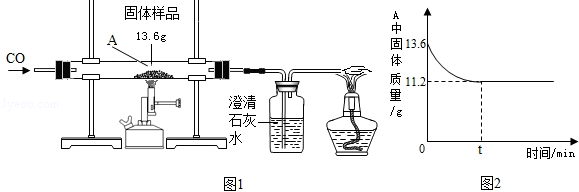
工业上侯氏制碱法得到的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验.在实验室中取27g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表: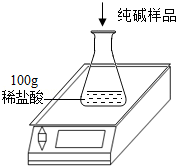
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是 g.
(2)计算纯碱样品中碳酸钠的质量分数是多少?(计算结果精确到0.1%)
(3)计算所用稀盐酸的质量分数是多少?
小黄同学为了测定某混合物(Na2CO3与NaOH混合)中碳酸钠的质量分数,进行了如下实验:称取了20g样品配成溶液,然后逐渐加入一定量质量分数为20.8%的BaCl2溶液(已知:Na2CO3+BaCl2=2NaCl+BaCO3↓),充分反应.在此过程中他进行了三次数据测定,结果如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 |
| 加入BaCl2溶液的质量/g | 60 | 120 | 150 |
| 生成沉淀的质量/g | 11.82 | 19.7 | 19.7 |
(1)第一次测定数据后所得溶液中含有溶质是NaOH, (填化学式);
(2)此实验中,实际参加反应的BaCl2溶液的质量为 ;
(3)样品中碳酸钠的质量分数为多少?(写出计算过程)
在实验室中,同学们用如图装置制取纯净的CO2,下列说法不正确的是( )
[查阅资料]饱和碳酸氢钠溶液可以吸收HCl而不吸收CO2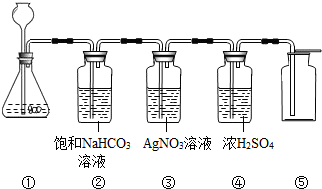
| A.①中固体反应物也可用Na2CO3固体代替 |
| B.③中没有白色沉淀产生,说明CO2气体中已经不混有HCl气体 |
| C.④中浓H2SO4的作用是吸收CO2气体中混有的H2O |
| D.将燃着的小木条放在⑤中的集气瓶口,可以检验集气瓶是否收集满CO2 |
 NaNO3+H2O+NH3↑;
NaNO3+H2O+NH3↑;