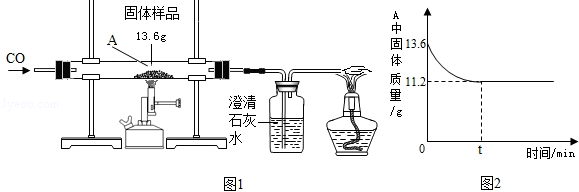
题目内容
为测定某碳酸钠溶液的溶质质量分数,小虎取100g该溶液,向其中滴加11.1%的氯化钙溶液直至不再产生沉淀,共用去氯化钙溶液100g,反应的化学方程式为:Na2CO3+CaCl2=2NaCl+CaCO3↓.求:
(1)碳酸钠溶液的溶质质量分数;
(2)反应后所得溶液的溶质质量分数(结果保留至0.1%).
(1)10.6% (2)6.2%
解析试题分析:(1)设碳酸钠溶液的溶质质量为x、与氯化钙反应生成的氯化钠的质量为y,碳酸钙的质量为z
氯化钙的质量为:100g×11.1%=11.1g
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 111 117 100
x 11.1g y z
解得:x=10.6g y=11.7g z=10g
碳酸钠溶液的溶质质量分数为: ×100%=10.6%
×100%=10.6%
(2)反应后所得溶液的溶质质量分数为: ×100%=6.2%
×100%=6.2%
答:(1)碳酸钠溶液的溶质质量分数为10.6%;
(2)反应后所得溶液的溶质质量分数为6.2%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题主要考查学生运用化学方程式进行计算的能力.学生须认真分析题意,找出各物质间的关系,正确写出方程式,并能根据质量分数公式计算,才能正确解答.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案甘肃祁连山水泥厂是我省规模较大的水泥厂,该厂的化验室为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表:
| | 反应前 | 反应后 | |
| 实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4g | 10g | 141.1g |
(1)该石灰石中碳酸钙的质量分数;
(2)所消耗10%的盐酸的质量.
工业上侯氏制碱法得到的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验.在实验室中取27g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表: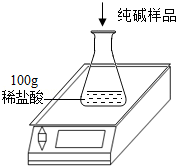
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是 g.
(2)计算纯碱样品中碳酸钠的质量分数是多少?(计算结果精确到0.1%)
(3)计算所用稀盐酸的质量分数是多少?
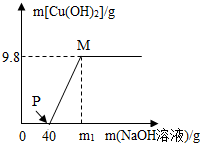
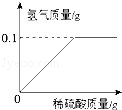
 NaNO3+H2O+NH3↑;
NaNO3+H2O+NH3↑;