题目内容
【题目】如图表示稀硫酸和氢氧化钠溶液发生反应时烧杯中溶液的pH随加入液体体积的变化曲线,请回答下列问题:
(1)烧杯中盛放的液体是______(填字母:A.稀硫酸B.氢氧化钠溶液),烧杯中发生反应的微观实质是______。
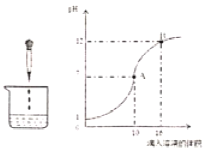
(2)曲线上A点表示______,B点时溶液中的离子有______(填离子符号)
(3)小强完成上述实验几天后发现,忘记盖上盛放氢氧化钠溶液试剂瓶的瓶塞。小强设计了如下实验两个方案来检验氢氧化钠溶液是否变质以及变质的程度
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取少量溶液于试管中,滴加几滴稀盐酸 | 没有气体产生 | 没有变质 |
方案二 | 取少量溶液于试管中,滴加几滴氢氧化钙溶液 | ① ______ | 已经变质 |
②小东认为方案一的实验设计不严谨,其原因是:______。请写出方案二中反应的化学方程式______。
③如果要确定氢氧化钠溶液是部分变质还是完全变质,以下方案合理的是______(填字母,已知氯化钙溶液呈中性)
A.另取溶液少许,加入适量氢氧化钙溶液,过滤,再向滤液中加入酚酞
B.另取溶液少许,加入足量的氯化钙溶液,过滤,再向滤液中加入酚酞
C.另取溶液少许,加入少量的氯化钙溶液,过滤,再向滤液中加入酚酞
【答案】A 氢氧根离子和氢离子结合生成水分子 稀硫酸和氢氧化钠恰好完全反应 Na+、OH-、SO42- 产生白色沉淀 如果少量的稀盐酸不足以和氢氧化钠反应,即使溶液中含有碳酸钠,也不产生气泡 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH B
【解析】
烧杯中pH由小于7逐渐升高,说明是把氢氧化钠溶液滴入稀硫酸中,烧杯中盛放的液体是稀硫酸,故填A;
烧杯中发生反应是氢氧化钠与硫酸反应生成硫酸钠和水,反应的微观实质是氢氧根离子和氢离子结合生成水分子,故填氢氧根离子和氢离子结合生成水分子。
(2)曲线上A点pH=7,表示稀硫酸和氢氧化钠恰好完全反应,生成的硫酸钠溶液呈中性,故填稀硫酸和氢氧化钠恰好完全反应;
B点时氢氧化钠过量,溶液中的离子有Na+、OH-、SO42-,故填Na+、OH-、SO42-。
(3)①实验结论为氢氧化钠已经变质,则溶液中一定由碳酸钠,加入氯化钙后,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,故填产生白色沉淀。
②方案一的实验设计不严谨,其原因是:如果少量的稀盐酸不足以和氢氧化钠反应,即使溶液中含有碳酸钠,也不产生气泡,故填如果少量的稀盐酸不足以和氢氧化钠反应,即使溶液中含有碳酸钠,也不产生气泡;
方案二中碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故反应的化学方程式写为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
③A.加入适量氢氧化钙溶液时,反应生成氢氧化钠溶液,不能检验溶液中是否含有氢氧化钠,选项错误;
B.另取溶液少许,加入足量的氯化钙溶液,过滤,再向滤液中加入酚酞,如果产生白色沉淀,说明溶液中含有碳酸钠,说明已经变质,反之则没有变质,如果酚酞试液变红色,说明溶液中含有氢氧化钠,如果酚酞试液不变色,说明溶液中不含有氢氧化钠,选项正确;
C.加入少量的氯化钙溶液时,如果不能把碳酸钠完全除去,则不能确定溶液中是否含有氢氧化钠,选项错误,故填B。

 初中学业考试导与练系列答案
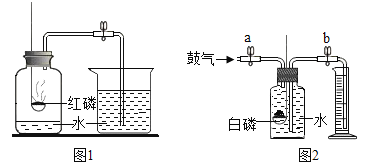
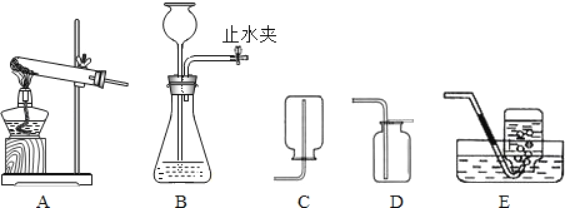
初中学业考试导与练系列答案【题目】下列实验方案及现象与结论一致的是
项目 | A | B | C | D |
方案 |
|
|
|
|
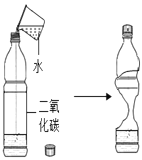
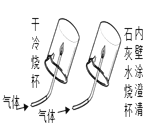
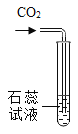
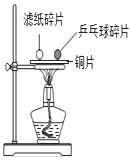
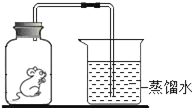
现象 | 旋紧瓶盖震荡,塑料瓶变瘪 | 点燃某气体后,干冷烧杯内壁出现无色液滴,澄清石灰水变浑浊 | 紫色石蕊试液在通入二氧化碳后变红 | 乒乓球碎片先燃烧,滤纸碎片后燃烧 |
结论 | CO2能溶于水且与水反应 | 该气体中一定有碳元素、氢元素和氧元素 | 使石蕊变红的是二氧化碳 | 说明燃烧条件之一是温度达到着火点 |
A. AB. BC. CD. D