题目内容
【题目】图1和图2是测定空气中氧气体积分数的实验装置图
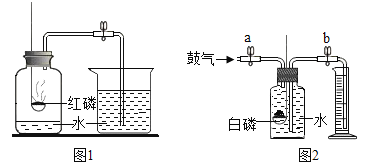
①图1所示实验过程中产生大量白烟反应的化学方程式是_____。
②如图2,集气瓶容积为200mL,量筒的量程为250mL,实验步骤如下(装置气密性良好,部分操作已略却,因试管产生的误差忽略不计),已知白磷在强光照射下易燃,燃烧产物与红磷相同。
I.打开止水夹a和b,向集气瓶中缓慢鼓入一定量空气,测得进入量筒中水的体积为V1,关闭止水夹a、b;
Ⅱ.强光照射引燃白磷
Ⅲ.白磷熄灭并冷却至室温,打开止水夹b,最终测得量筒中的体积变为V2;
Ⅳ.计算空气中氧气的体积分数
请回答下列问题:
(1)下列有关这个实验的说法中,正确的是_____(填序号)
①步骤I中鼓入空气的体积可以小于200mL的任意体积
②若步骤I中只关闭止水夹a,不关闭止水夹b可能造成测得氧气的体积分数偏大
③与图1相比,图2装置的优点有:误差减少和污染减少
(2)正确选用测量数据或字母表示空气中氧气的体积分数的计算式为_____。
【答案】4P+5O2![]() 2P2O5 ②③
2P2O5 ②③ ![]()
【解析】
①磷与氧气在点燃的条件下反应生成五氧化二磷,故反应的化学方程式写为:4P+5O2![]() 2P2O5;
2P2O5;
②(1)①步骤Ⅰ中,鼓入空气的体积至少应该使红磷露出水面,选项错误;
②若步骤I中只关闭止水夹a,不关闭止水夹b,在白磷燃烧时,部分空气受热逸出,造成装置冷却至室温后,进入的水偏多,测得氧气的体积分数偏大,选项正确;
③与图1相比,图2装置的优点有:误差减少和污染减少,选项正确,故选②③。
(2)步骤Ⅳ中,氧气的体积分数为:![]() ,故填:
,故填:![]() 。
。

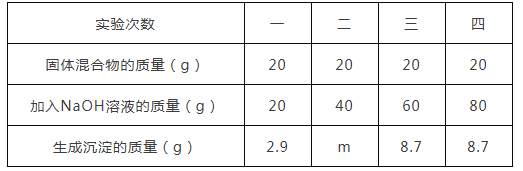
【题目】我国空气质量标准对空气中SO2的浓度级别规定如下表所示(空气中SO2的浓度用单位体积的空气中所含SO2的质量表示)。
浓度级别 | SO2标准(mg/m3) |
一级 | 浓度≤0.15 |
二级 | 0.15<浓度≤0.50 |
三级 | 0.50<浓度≤0.70 |
某中学化学兴趣小组为测定当地空气中SO2的含量。将2m3空气通入一定含量碘(I2)2.54mg的碘水中,经测定I2与SO2恰好完全反应,该反应的化学方程式是: SO2 + I2 + 2H2O =H2SO4 + 2HI 。此空气中SO2的浓度级别是____。
【题目】如图表示稀硫酸和氢氧化钠溶液发生反应时烧杯中溶液的pH随加入液体体积的变化曲线,请回答下列问题:
(1)烧杯中盛放的液体是______(填字母:A.稀硫酸B.氢氧化钠溶液),烧杯中发生反应的微观实质是______。
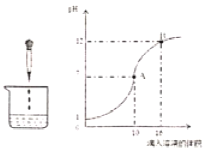
(2)曲线上A点表示______,B点时溶液中的离子有______(填离子符号)
(3)小强完成上述实验几天后发现,忘记盖上盛放氢氧化钠溶液试剂瓶的瓶塞。小强设计了如下实验两个方案来检验氢氧化钠溶液是否变质以及变质的程度
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取少量溶液于试管中,滴加几滴稀盐酸 | 没有气体产生 | 没有变质 |
方案二 | 取少量溶液于试管中,滴加几滴氢氧化钙溶液 | ① ______ | 已经变质 |
②小东认为方案一的实验设计不严谨,其原因是:______。请写出方案二中反应的化学方程式______。
③如果要确定氢氧化钠溶液是部分变质还是完全变质,以下方案合理的是______(填字母,已知氯化钙溶液呈中性)
A.另取溶液少许,加入适量氢氧化钙溶液,过滤,再向滤液中加入酚酞
B.另取溶液少许,加入足量的氯化钙溶液,过滤,再向滤液中加入酚酞
C.另取溶液少许,加入少量的氯化钙溶液,过滤,再向滤液中加入酚酞