题目内容
【题目】金属材料广泛应用于生产生活中。2018年5月13日,我国首艘001A型国产航母开始海试,标志着我国在航海及军事领域取得重大突破。根据所学知识填空。
(1)建造航母用到了钛合金,构成金属钛的粒子是____________(填“原子”“分子”或“离子”),工业制钛有一种反应为:TiF4+2H2SO4![]() 4HF+2X+TiO2,X的化学式为____________。
4HF+2X+TiO2,X的化学式为____________。
(2)航母外壳用涂料覆盖,是为了防止钢铁材料与______________接触而锈蚀,而金属铝在空气中更耐腐蚀的原因是______________________________(用化学方程式表示)
(3)为了探究航母材料中锌、铁、铜三种金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是_________________(填序号)。
A.稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉
B.ZnCl2溶液中加入足量铁粉后,再加入CuCl2溶液
C.ZnCl2溶液中加入足量铜粉后,再加入铁粉
(4)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_____________________________(写化学式)。
【答案】原子 SO3 氧气和水 4Al+3O2=2Al2O3 AB FeCl2、ZnCl2
【解析】
(1)金属是由原子直接构成的,故构成金属钛的粒子是原子;根据质量守恒定律反应前后原子的种类及数目不变可知,反应物中有1个钛原子、4个氟原子、4个氢原子、2个硫原子、8个氧原子,生成物中含有4个氢原子、4个氟原子、1个钛原子、2个氧原子,所以两个X分子中有2个硫原子、6个氧原子,故每个X分子中含1个硫原子、3个氧原子,X的化学式为:SO3。
(2)铁在潮湿的空气中最容易锈蚀,故航母外壳用涂料覆盖,是为了防止钢铁材料与氧气和水接触而锈蚀;而金属铝在空气中更耐腐蚀的原因是:铝与氧气生成致密的氧化铝薄膜,反应的方程式为:4Al+3O2=2Al2O3。
(3)A、稀盐酸中加入足量铁粉后,生成了氯化亚铁和氢气,再加铜粉,不反应,说明了铁的金属活动性大于铜,最后加入锌粉,能将铁置换出来,说明了锌的活动性大于铁,可以比较金三种属的活动性强弱,故A正确;
B、ZnCl2溶液中加入足量铁粉后,不反应,说明了锌的活动性大于铁,再加入CuCl2溶液,能反应,说明了铁的活动性大于铜,可以比较金三种属的活动性强弱,故B正确;
C、ZnCl2溶液中加入足量铜粉后,再加入铁粉,都不反应,说明了锌的活动性大于铜、铁,但不能比较铜和铁的活动性强弱,不可以比较金三种属的活动性强弱,故C错误;故选AB。
(4)根据金属活动性顺序表可知,锌>铁>氢>铜,向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,铁与盐酸反应生成氯化亚铁和氢气;铁能将氯化铜全部反应生成氯化亚铁和铜,不能与氯化锌反应。充分反应后,过滤,滤液中无氯化铜,有生成的氯化亚铁和原来的氯化锌,化学式为:FeCl2、ZnCl2。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】如图表示稀硫酸和氢氧化钠溶液发生反应时烧杯中溶液的pH随加入液体体积的变化曲线,请回答下列问题:
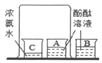
(1)烧杯中盛放的液体是______(填字母:A.稀硫酸B.氢氧化钠溶液),烧杯中发生反应的微观实质是______。
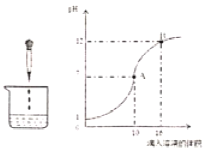
(2)曲线上A点表示______,B点时溶液中的离子有______(填离子符号)
(3)小强完成上述实验几天后发现,忘记盖上盛放氢氧化钠溶液试剂瓶的瓶塞。小强设计了如下实验两个方案来检验氢氧化钠溶液是否变质以及变质的程度
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取少量溶液于试管中,滴加几滴稀盐酸 | 没有气体产生 | 没有变质 |
方案二 | 取少量溶液于试管中,滴加几滴氢氧化钙溶液 | ① ______ | 已经变质 |
②小东认为方案一的实验设计不严谨,其原因是:______。请写出方案二中反应的化学方程式______。
③如果要确定氢氧化钠溶液是部分变质还是完全变质,以下方案合理的是______(填字母,已知氯化钙溶液呈中性)
A.另取溶液少许,加入适量氢氧化钙溶液,过滤,再向滤液中加入酚酞
B.另取溶液少许,加入足量的氯化钙溶液,过滤,再向滤液中加入酚酞
C.另取溶液少许,加入少量的氯化钙溶液,过滤,再向滤液中加入酚酞
【题目】某化学兴趣小组为探究化学反应中的能量变化,进行以下实验:
(探究一)盐酸与氢氧化钠的反应
(1)写出氢氧化钠溶液与盐酸反应的化学方程式:_________________________________。
(2)甲同学设计实验:向一定量氢氧化钠固体中倒入20mL 4%盐酸,用温度计测量反应前后各溶液的温度。乙同学认为该实验方案不合理,其理由是_________________________。
(3)丙同学设计了如下三组实验,请你帮助他完成实验方案:
实验编号 | 实验方案 |
实验1 | 向20mL 4%盐酸中倒入20mL水,测定稀释前后溶液的温度。 |
实验2 | 向20mL 5%氢氧化钠溶液中________________,测定稀释前后溶液的温度。 |
实验3 | _______________________________________________________________。 |
(4)丙同学观察到的实验现象是:实验3溶液升高的温度远大于实验1与实验2溶液升高的温度之和,由此你能得出的实验结论是①____________;②____________。
(探究二)盐酸与碳酸氢钠溶液的反应。
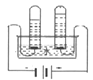
下图是丁同学在20℃、基本隔热条件下利用温度传感器,分别测定向20mL水和20mL饱和碳酸氢钠溶液中各倒入20mL 13.7%盐酸的温度与时间变化曲线。
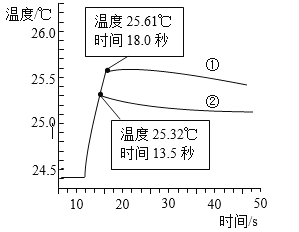
曲线①为水+13.7%盐酸温度变化曲线
曲线②为饱和碳酸氢钠溶液+13.7%盐酸温度变化曲线
实验测得饱和碳酸氢钠溶液稀释时温度变化不大,可忽略不计,据此回答下列问题:
(5)18.0秒后,曲线①逐渐下降的原因是____________________________________;
(6)比较曲线①和曲线②,你认为13.7%盐酸与饱和碳酸氢钠溶液的反应是________(填“放热”或“吸热”)反应,其理由是_________________________。