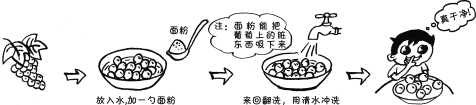
题目内容
【题目】取碳酸钠和氯化钠的混合物16g,加入150g水使其完全溶解,再加入100g氯化钡溶液恰好完全反应,过滤,得246.3g滤液(不考虑实验过程中质量损失)。计算(结果精确到0.1%):
(1)该混合物中碳酸钠的质量分数。
(2)反应后所得滤液中溶质的质量分数。
【答案】(1)66.3%(2)6.9%
【解析】
生成的碳酸钡质量:16g+150g+100g-246.3g=19.7g
解:设碳酸钠质量为x,生成的氯化钠质量为y。
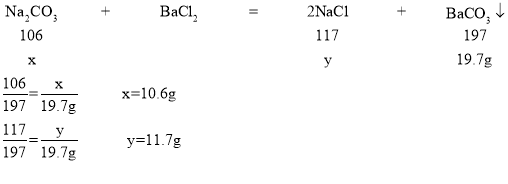
(1)该混合物中碳酸钠的质量分数:![]() ;反应后所得滤液中氯化钠的质量:16g-10.6g+11.7g=17.1g
;反应后所得滤液中氯化钠的质量:16g-10.6g+11.7g=17.1g
(2)反应后所得滤液中溶质的质量分数:![]()
答:(1)该混合物中硫酸钠的质量分数为66.3%;
(2)反应后所得滤液中溶质的质量分数为6.9%。

【题目】化学实验小组的同学在实验室里发现桌上有瓶敞口放置已久的NaOH溶液,他们对溶质的成分产生了探究的欲望。
[提出问题]这瓶NaOH溶液一定变质了,其变质程度如何呢?
[提出猜想]猜想一:NaOH溶液部分变质
猜想二:NaOH溶液完全变质
[实验探究]
(1)氢氧化钠溶液变质的原因为_____(用化学方程式表示)。
(2)小组的同学设计了如下实验进行探究,请根据表中内容填写:
实验步骤 | 现象 | 结论 | |
步骤一 | 取少量NaOH溶液样品于试管中,向其中滴加过量的CaCl2溶液 | 产生白色沉淀 | 猜想__成立 |
步骤二 | 过滤,向滤液中滴加酚酞试液 | 溶液变红色 | |
上述步骤一中,滴加过量CaCl2溶液的目的是____;步骤二中根据酚酞试液变红这一现象证明样品中含有___(填字母)。
A CaCl2
B Na2CO3
C NaOH
D Na2CO3和NaOH
[实验反思]
(1)下列物质中①BaCl2溶液、②Ca( NO3)2溶液、③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代步骤一中CaCl2溶液的是____(填序号)。
(2)步骤二中用另外一种试剂代替酚酞试液也能得出同样的结论,发生反应的化学方程式为________。
(3)通过探究,实验室中的氢氧化钠应密封保存。
【题目】下表是几种物质在20℃的溶解度和相对分子质量。回答下列问题:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 9.6 | 37.2 | 21.0 |
相对分子质量 | 58.5 | 84 | 53.5 | 79 |
(1)20℃时,用50g蒸馏水配制饱和NaHCO3溶液。
①计算需称量NaHCO3的质量是_____g。
②将称量的NaHCO3固体倒入盛有50g蒸馏水的烧杯中,然后用_____(填仪器名称)不断搅拌,直至_____。
③用配制所得的溶液可处理溶质的质量分数为1%的稀H2SO4_____g。
(2)相同温度下,不同溶质同时溶解在同一溶剂中,溶解度不变。在20℃时,将11.7gNaCl固体和15.8gNH4HCO3固体同时放入盛有100g水的烧杯中,充分搅拌,静置,观察到烧杯底部有晶体出现,该过程只发生复分解反应。杯底的晶体是_____,杯底晶体的质量是_____g。