题目内容
【题目】下表是几种物质在20℃的溶解度和相对分子质量。回答下列问题:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 9.6 | 37.2 | 21.0 |
相对分子质量 | 58.5 | 84 | 53.5 | 79 |
(1)20℃时,用50g蒸馏水配制饱和NaHCO3溶液。
①计算需称量NaHCO3的质量是_____g。
②将称量的NaHCO3固体倒入盛有50g蒸馏水的烧杯中,然后用_____(填仪器名称)不断搅拌,直至_____。
③用配制所得的溶液可处理溶质的质量分数为1%的稀H2SO4_____g。
(2)相同温度下,不同溶质同时溶解在同一溶剂中,溶解度不变。在20℃时,将11.7gNaCl固体和15.8gNH4HCO3固体同时放入盛有100g水的烧杯中,充分搅拌,静置,观察到烧杯底部有晶体出现,该过程只发生复分解反应。杯底的晶体是_____,杯底晶体的质量是_____g。
【答案】4.8 玻璃棒 固体完全溶解 280 NaHCO3 7.2
【解析】
(1)①20℃时,NaHCO3的溶解度为9.6g,则100g水中溶解9.6g NaHCO3形成饱和溶液,那么50g蒸馏水中溶解4.8g NaHCO3形成饱和溶液,故需称量NaHCO3的质量是4.8g;
②溶解固体物质一般在烧杯中进行,溶解过程中要用玻璃棒不断搅拌,直至固体完全溶解;
③设配制好的溶液可处理溶质的质量分数为1%的稀H2SO4溶液的质量为x;
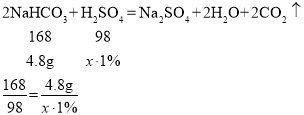
解得x=280g,即可处理溶质的质量分数为1%的稀H2SO4溶液的质量为280g;
(2)由题意,NaCl和NH4HCO3发生复分解反应生成NH4Cl和NaHCO3,质量关系为
![]()
则11.7gNaCl固体和15.8gNH4HCO3固体恰好反应生成10.7gNH4Cl和16.8g NaHCO3,又因为20℃时,NH4Cl的溶解度为37.2g,而NaHCO3的溶解度为9.6g,则NH4Cl可以全部溶解,NaHCO3不能全部溶解,杯底的晶体是NaHCO3,杯底晶体的质量是16.8g-9.6g=7.2g。

【题目】为探究某物质 X 对钢铁在潮湿环境下的腐蚀的影响作用,某同学进行了如下实验:
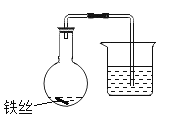
① 选择 6 个容量相同的烧瓶,分别编号为 1~6,加入规格、质量相同的铁丝。
② 向 1~3 号瓶中放入 2mL 清水,向 4~6 号瓶中放入 2mL10%X 的水溶液,将铁丝润湿。
③ 塞上带有导管的塞子,将导管末端浸入盛有水的烧杯中,记录导管内液面的初始位置(如图所示)。
④ 放在室温环境下,每隔一小时测量一次,周期为 3 小时,记录数据。结果如下表所示:
时间(小时) | 1 号瓶 | 2 号瓶 | 3 号瓶 | 4 号瓶 | 5 号瓶 | 6 号瓶 |
0 | 0 | 0 | 0 | 0 | 0 | 0 |
1 | 0 | 0.1 | 0 | 1.2 | 1.4 | 0 |
2 | 0.8 | 0.7 | 0.9 | 5.6 | 5.7 | 0.1 |
3 | 3.5 | 3.2 | 3.7 | 9.8 | 10.0 | 0.1 |
注:放置过程中导管内液面上升情况(单位:cm)
(1)在该项探究中,要取同样处置的 3 只烧瓶的目的是_。
(2)6 号瓶的数据明显与 4、5 号瓶不同,可能原因是_。
(3)通过本实验,可初步得出的结论是_。
(4)该项探究的设计是否存在不足_?如何改进_?
【题目】下表是不同温度下硝酸钾的溶解度,下列有关说法正确的是
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
A.20°C时,100 g硝酸钾饱和溶液中含硝酸钾的质量是31.6g
B.接近饱和的硝酸钾溶液可通过升高温度的方法变为饱和溶液
C.60°C时,将60g硝酸钾固体在50g水中溶解,可得到110g的硝酸钾溶液
D.将80°C时硝酸钾饱和溶液降温至20°C,此时硝酸钾溶液溶质的质量分数约为24%