题目内容
【题目】在化学学习过程中,我们常常需要通过科学探究来认识物质,研究物质的化学变化,请你一起参与下列实验探究。
(探究Ⅰ:以过氧化氢分解为研究对象进行实验,探究影响化学反应速率的因素)
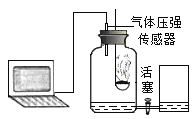
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为_____________________。
结果:长时间(大于100s),收集到很少量气体。
更正结论:红砖粉末有催化作用,三者中MnO2催化效率最高。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1。
乙同学:取10mL2.5%H2O2溶液,加入0.5g CuO为催化剂,进行实验,记录时间t2。
实验结果t1______t2(填“>”或“<”)。
结论:浓度越大,反应速率越快。
丙同学:对实验设计提出疑问,并补充实验___________________,
记录时间t3,且t1<t3<t2。
更正结论为:当催化剂种类及质量相同时,反应物浓度越大,____________。
C组:探究__________对化学反应速率的影响。
取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴记录时间t4、t5,且t4>t5。
结论:当反应物浓度和催化剂相同时,_____________________。
综上所述:为了研究某一因素对化学反应速率的影响,必须只允许有一个变量,其他量必须相同。
(探究Ⅱ:二氧化碳的性质探究)
铁丝(含碳量0.69%)在氧气中燃烧,铁丝燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是___________(填名称)。
查阅资料:①CO2和SO2溶于水后具有相似的化学性质②硫是淡黄色固体
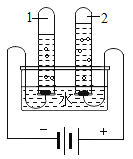
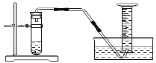
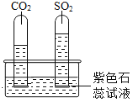
实验一:水槽中滴入紫色石蕊,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2_____(填“>”或“<”)CO2,试管内溶液变成____________色。
实验二:已知镁条可以在CO2中剧烈燃烧,反应为:Mg+CO2![]() MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧、放出热量________________。
MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧、放出热量________________。
【答案】取5mL10%H2O2溶液,不放催化剂进行实验 < 取10mL5%H2O2溶液,加入0.5g CuO为催化剂,进行实验(或取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验) 反应速率越快 温度 温度越高,反应速率越快 二氧化碳 > 红 产生白色和淡黄色固体
【解析】
[探究Ⅰ:以过氧化氢分解为研究对象进行实验,探究影响化学反应速率的因素]
A组:由实验步骤和结论可知,MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,要想得出此结论,则需要补充一次不加催化剂的对照组,比较时间的长短,来比较。故补充的实验操作为:取5mL10%H2O2溶液,不放催化剂进行实验。故填:取5mL10%H2O2溶液,不放催化剂进行实验。
B组:由甲同学和乙同学的实验对比,若t1<t2,则可得出结论:浓度越大,反应速率越快。故填:<。
由于甲乙同学实验时,采用的是不同的催化剂,没有做到控制单一变量,因此不能得出正确结论,丙同学:对实验设计提出疑问,并补充的实验为:取10mL5%H2O2溶液,加入0.5g CuO为催化剂,进行实验(或取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验),此时记录时间t3,且t1<t3<t2。可将结论更正为:当催化剂种类及质量相同时,反应物浓度越大,反应速率越快。
C组:由实验步骤:取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴记录时间t4、t5,可知探究的是温度对化学反应速率的影响。故填:温度。
根据时间t4>t5。可以得出结论为:当反应物浓度和催化剂相同时,温度越高,反应速率越快。故填:温度越高,反应速率越快。
[探究Ⅱ:二氧化碳的性质探究]
日常生活中的钢铁制品都含有少量碳杂质,含碳细铁丝燃烧时,其中的碳会生成的CO2气体;故填:二氧化碳。
实验一:水槽中滴入紫色石蕊,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示进入二氧化硫试管中液体更多,说明相同条件下的溶解性:SO2>CO2,由资料:①CO2和SO2溶于水后具有相似的化学性质,二氧化硫和二氧化碳溶于水会与水反应生成相应的酸,使得溶液呈酸性,故试管内溶液变成红色。故填:>;红。
实验二:已知镁条可以在CO2中剧烈燃烧,反应为:2Mg+CO2![]() 2MgO+C,由于CO2和SO2溶于水后具有相似的化学性质,因此可以试推测镁条在SO2中燃烧的化学方程式为:2Mg+SO2
2MgO+C,由于CO2和SO2溶于水后具有相似的化学性质,因此可以试推测镁条在SO2中燃烧的化学方程式为:2Mg+SO2![]() 2MgO+S,硫是淡黄色固体,因此现象为:剧烈燃烧、放出热量,产生白色和淡黄色固体。故填:产生白色和淡黄色固体。
2MgO+S,硫是淡黄色固体,因此现象为:剧烈燃烧、放出热量,产生白色和淡黄色固体。故填:产生白色和淡黄色固体。

 阅读快车系列答案
阅读快车系列答案