题目内容
【题目】根据下列装置,结合所学化学知识回答下列问题。
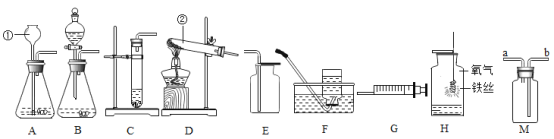
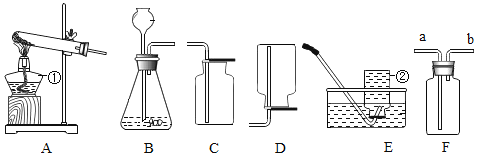
(1)请写出图中标号仪器的名称:① ____________;
(2)实验室用过氧化氢制取少量纯净的氧气时,发生装置最好选用______ ,收集装置应选用_______ ;如需随时控制生产气体的量并节约药品,发生装置最好选用______(填编号)。
(3)实验室用高锰酸钾制取氧气时,发生装置应选用____(填编号);写出其反应的符号表达式__________________。实验中,试管口略向下倾斜,目的是_________________。
(4)如用E装置收集O2,检验O2是否收集满的方法是 ____________。
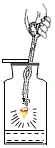
(5)如图H,铁丝在氧气中燃烧的实验现象为_______________;实验中要注意:瓶底预先放入少量水的目的是________________;铁丝绕成螺旋状的目的是____________;铁丝前端要系一根火柴,作用为________。
(6)注射器G可用于检查装置A的气密性,步骤如下:
①向锥形瓶中加入少量水,使长颈漏斗下端在水面下。
②将注射器C连接到装置A的导管口处。
③缓慢推动注射器G的活塞,观察到____________,表示装置A的气密性良好。
(7)若用装置F收集的氧气不纯,其原因可能是(请写两种原因):①___________;②________________。
(8)在学生实验课上,小林用高锰酸钾制取了一瓶氧气,呈浅红色,在做细铁丝燃烧实验时,未见细铁丝燃烧。而小红异常兴奋,实验成功了!但实验结束后,拿了集气瓶怯生生地走到了老师旁,说:我的集气瓶碎了。分析两位同学实验操作中出现的问题的原因。
小林:_______________________________;(答一条)
小红:_______________________________。(答一条)
【答案】长颈漏斗 C F B D KMnO4![]() K2MnO4+MnO2+O2 防止水蒸气冷凝回流,造成试管炸裂 将带火星的木条伸到集气瓶口,观察是否复燃 剧烈燃烧,火星四射,放出大量的热,产生黑色固体 防止铁丝剧烈燃烧产生高温熔融物溅落,造成集气瓶炸裂 增大铁丝的受热面积,更加充分反应 引燃 长颈漏斗末端液面上升 收集气体前,集气瓶内水没有装满 玻璃导管刚开始产生气泡,就开始收集气体 收集氧气纯度不够(答案合理即可) 集气瓶底部未留少量水(答案合理即可)
K2MnO4+MnO2+O2 防止水蒸气冷凝回流,造成试管炸裂 将带火星的木条伸到集气瓶口,观察是否复燃 剧烈燃烧,火星四射,放出大量的热,产生黑色固体 防止铁丝剧烈燃烧产生高温熔融物溅落,造成集气瓶炸裂 增大铁丝的受热面积,更加充分反应 引燃 长颈漏斗末端液面上升 收集气体前,集气瓶内水没有装满 玻璃导管刚开始产生气泡,就开始收集气体 收集氧气纯度不够(答案合理即可) 集气瓶底部未留少量水(答案合理即可)
【解析】
(1)长颈漏斗
(2)实验室用过氧化氢制取少量纯净的氧气时选择固、液发生装置C,用排水法收集氧气,选择装置F收集气体;装置B中有分液漏斗,可以随时控制生产气体的量并节约药品;
(3)实验室用高锰酸钾制取氧气时选择固体加热装置D,高锰酸钾制氧气反应原理:KMnO4![]() K2MnO4+MnO2+O2;试管口略微向下是为了:防止水蒸气冷凝回流,造成试管炸裂;
K2MnO4+MnO2+O2;试管口略微向下是为了:防止水蒸气冷凝回流,造成试管炸裂;
(4)E装置是万能瓶收集氧气,验满氧气的操作是:将带火星的木条伸到集气瓶口,观察是否复燃;
(5)铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,产生黑色固体;瓶底硫水的原因是:防止铁丝剧烈燃烧产生高温熔融物溅落,造成集气瓶炸裂;铁丝绕成螺旋状的是为了:增大铁丝的受热面积,更加充分反应;铁丝前端要系一根火柴是为了引燃铁丝;
(6)缓慢推动注射器G的活塞,气体被压缩,锥形瓶内压强变大,长颈漏斗末端液面上升;
(7)若用排水法装置F收集的氧气不纯,其原因可能是:1收集气体前,集气瓶内水没有装满,混有空气2玻璃导管刚开始产生气泡,就开始收集气体,因为刚开始产生的气泡是装置内的空气;
(8)小林实验室失败的原因是收集的氧气纯度不够,铁丝不能燃烧;小红实验后集气瓶炸裂的原因是实验前集气瓶内未留一定量的水用于隔热;

【题目】在化学学习过程中,我们常常需要通过科学探究来认识物质,研究物质的化学变化,请你一起参与下列实验探究。
(探究Ⅰ:以过氧化氢分解为研究对象进行实验,探究影响化学反应速率的因素)
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。
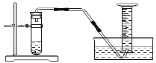
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为_____________________。
结果:长时间(大于100s),收集到很少量气体。
更正结论:红砖粉末有催化作用,三者中MnO2催化效率最高。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1。
乙同学:取10mL2.5%H2O2溶液,加入0.5g CuO为催化剂,进行实验,记录时间t2。
实验结果t1______t2(填“>”或“<”)。
结论:浓度越大,反应速率越快。
丙同学:对实验设计提出疑问,并补充实验___________________,
记录时间t3,且t1<t3<t2。
更正结论为:当催化剂种类及质量相同时,反应物浓度越大,____________。
C组:探究__________对化学反应速率的影响。
取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴记录时间t4、t5,且t4>t5。
结论:当反应物浓度和催化剂相同时,_____________________。
综上所述:为了研究某一因素对化学反应速率的影响,必须只允许有一个变量,其他量必须相同。
(探究Ⅱ:二氧化碳的性质探究)
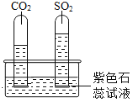
铁丝(含碳量0.69%)在氧气中燃烧,铁丝燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是___________(填名称)。
查阅资料:①CO2和SO2溶于水后具有相似的化学性质②硫是淡黄色固体
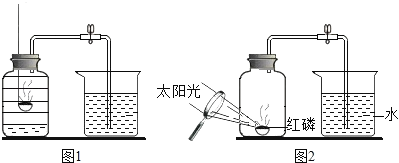
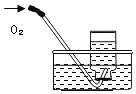
实验一:水槽中滴入紫色石蕊,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2_____(填“>”或“<”)CO2,试管内溶液变成____________色。
实验二:已知镁条可以在CO2中剧烈燃烧,反应为:Mg+CO2![]() MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧、放出热量________________。
MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧、放出热量________________。
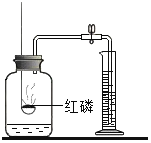
【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
选项 | A | B | C | D |
实 验 装 置 |
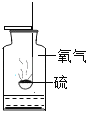
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:用水将集气瓶内的空气排净后,便于观察O2何时收集满 |
A.AB.BC.CD.D