题目内容
【题目】已知 Na2CO3与 HCl 反应分两步进行:
第一步 Na2CO3与 HCl 反应生成 NaHCO3:![]() ;
;
第二步 NaHCO3 与 HCl 反应生成 CO2:![]() 。
。
现有这样一个实验:在两支试管中分别加入 3mL 稀盐酸,将两个各装有 0.3g NaHCO3 或 Na2CO3 粉末的小气球分别套在两支试管口,将气球内的NaHCO3或 Na2CO3 同时倒入试管中(反应中盐酸足量)。观察到现象如下:
(1)盛________的试管中产生气体的速率要快得多。
(2)盛_________的试管中气球变得更大,大小气球中生成气体的质量之比为(填最简单整数比)_____。
(3)甲同学用手触摸试管,发现盛 NaHCO3 粉末的试管变冷,而盛 Na2CO3的试管温度有升高。为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做 3 次平行实验,取平均值):
序号 | 试剂 1 | 试剂 2 | 混合前温度 | 混合后温度 |
① | 35mL 水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL 水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液 32.5mL | 20℃ | 19℃ |
④ | 35mL 稀盐酸 | 含 3.2g Na2CO3的饱和溶液 23.1mL+10ml 水 | 20℃ | 24.2℃ |
⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出五条结论:
①NaHCO3 的溶解是__(吸热或放热)过程;
②Na2CO3 的溶解是____(吸热或放热)过程;
③NaHCO3 的饱和溶液和盐酸的反应是___(吸热或放热)反应;
④Na2CO3 的饱和溶液和盐酸的反应是____(吸热或放热)反应;
⑤NaHCO3 固体与稀盐酸反应的反应热是由_____(填①~⑤序号)的热效应之和。
【答案】NaHCO3 NaHCO3 53:42 吸热 放热 吸热 放热 ①③
【解析】
首先读懂信息:碳酸钠与盐酸的反应分两步进行,所以可以判断碳酸氢钠反应更快;利用相同质量的物质,根据化学方程式的计算,可以得到产生二氧化碳的质量比;对表格的实验进行对比分析得出放热还是吸热。
(1)利用题中所给信息知碳酸钠与盐酸的反应是分两步进行,而碳酸氢钠与盐酸是一步进行,盛NaHCO3的试管中产生气体的速率要快得多。
(2)0.3g NaHCO3 或 Na2CO3分别与盐酸反应(反应中盐酸足量),分别计算生成二氧化碳的质量:
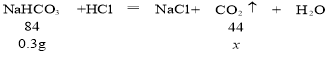
![]()
解得:![]() =
=![]() ≈ 0.16g,
≈ 0.16g,
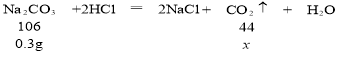
![]()
解得:![]() =
=![]() ≈ 0.12g
≈ 0.12g
所以NaHCO3产生的二氧化碳多,盛NaHCO3的试管中气球变得更大,大小气球中生成气体的质量之比为:![]() =53:42;
=53:42;
(3)①水的混合前温度20℃,加入NaHCO3混合后温度18.5℃,则NaHCO3的溶解是为吸热过程;
②水的混合前温度20℃,加入Na2CO3混合后温度24.3℃,则Na2CO3的溶解是为放热过程;
③稀盐酸、NaHCO3的饱和溶液的混合前温度20℃,混合后温度19℃,则NaHCO3的饱和溶液和盐酸的反应是吸热过程;
④稀盐酸、Na2CO3的饱和溶液的混合前温度20℃,混合后温度24.2℃,则Na2CO3的饱和溶液和盐酸的反应是放热过程;
⑤NaHCO3固体与稀盐酸反应的反应热是由碳酸氢钠固体溶于水的热效应与碳酸氢钠溶液与稀盐酸反应的热效应之和,即①③之和。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】阅读下面科普短文。
炭烧酸奶近年来发展迅速,其焦香浓郁的风味深受消费者喜爱。炭烧酸奶在制作过程中通过牛奶的长时间褐变,获得浓郁的焦香风味。牛奶褐变,是一系列化合物受热发生反应的过程。褐变生产工艺中需对葡萄糖用量、褐变温度和褐变时间三个重要条件进行严格控制。葡萄糖用量与产品颜色、风味密切相关,具体影响如图 2 所示,其中评分越高,产品的颜色、风味越好。褐变温度和时间的组合是调节蛋白稳定、避免沉淀分层的重要因素,具体影响如表所示,其中沉淀率越低产品越稳定。

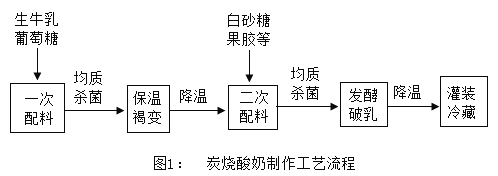
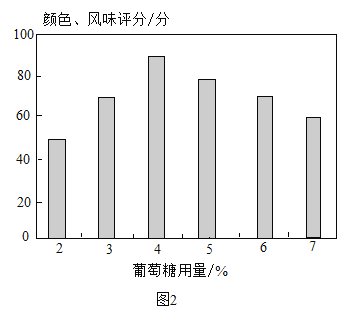
表:褐变温度和时间对牛奶褐变沉淀率的影响
褐变温度/℃ | 86 | 88 | 90 | 92 | 94 | 96 |
褐变时间/h | 6 | 4 | 3.5 | 3 | 2.5 | 2 |
沉淀率/% | 0.35 | 0.31 | 0.27 | 0.22 | 0.14 | 0.44 |
优质的制作工艺可使炭烧酸奶口感爽滑,在保质期内状态稳定。依据文章内容回答下列问题。
(1)葡萄糖(C6H12O6)的相对分子质量是180,计算式为______。
(2)制作炭烧酸奶的原料有___________。
(3)牛奶褐变过程中,影响蛋白稳定的因素有_____________。
(4)由图表可知,牛奶褐变过程的最佳条件为_________。
(5)下列说法正确的是______(填序号)。
A 炭烧酸奶的特色是其浓郁的焦香风味
B 葡萄糖用量影响产品的颜色和风味
C 褐变温度越高,炭烧酸奶产品越稳定
D 炭烧酸奶制作过程中需将各种原料一次性混合均匀