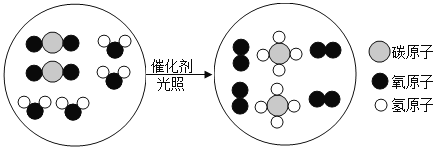
题目内容
【题目】科学家最近在-100℃的低温下合成一种化合物 X,此分子的模型如下图,其中每个![]() 代 表一个碳原子,每个
代 表一个碳原子,每个![]() 代表一个氢原子。下列说法中不正确的是
代表一个氢原子。下列说法中不正确的是

A.该分子的分子式为 C5H4
B.该分子中碳元素的质量分数是 93.75%
C.该物质中碳元素的化合价为+4 价
D.等质量的该物质与甲烷相比,燃烧时该物质消耗的氧气更多
【答案】CD
【解析】
A、该物质的分子由五个碳原子和四个氢原子所构成,因此该物质的化学式可写为C5H4,故正确;
B、C5H4中碳元素的质量分数为:![]() ×100%=93.75%,故正确;
×100%=93.75%,故正确;
C、该物质的化学式可写为C5H4,氢元素显+1价,根据化合物正负化合价和为零,可推知,该物质中碳元素的化合价一定不是+4价,故错误;
D、设该物质与甲烷都为1克,则设燃烧时消耗的氧气分别为x、y,

![]()
x=3g,

![]()
y=4g,
所以等质量的该物质与甲烷相比,燃烧时消耗的氧气更少,故错误。
故选CD。

【题目】已知 Na2CO3与 HCl 反应分两步进行:
第一步 Na2CO3与 HCl 反应生成 NaHCO3:![]() ;
;
第二步 NaHCO3 与 HCl 反应生成 CO2:![]() 。
。
现有这样一个实验:在两支试管中分别加入 3mL 稀盐酸,将两个各装有 0.3g NaHCO3 或 Na2CO3 粉末的小气球分别套在两支试管口,将气球内的NaHCO3或 Na2CO3 同时倒入试管中(反应中盐酸足量)。观察到现象如下:
(1)盛________的试管中产生气体的速率要快得多。
(2)盛_________的试管中气球变得更大,大小气球中生成气体的质量之比为(填最简单整数比)_____。
(3)甲同学用手触摸试管,发现盛 NaHCO3 粉末的试管变冷,而盛 Na2CO3的试管温度有升高。为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做 3 次平行实验,取平均值):
序号 | 试剂 1 | 试剂 2 | 混合前温度 | 混合后温度 |
① | 35mL 水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL 水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液 32.5mL | 20℃ | 19℃ |
④ | 35mL 稀盐酸 | 含 3.2g Na2CO3的饱和溶液 23.1mL+10ml 水 | 20℃ | 24.2℃ |
⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出五条结论:
①NaHCO3 的溶解是__(吸热或放热)过程;
②Na2CO3 的溶解是____(吸热或放热)过程;
③NaHCO3 的饱和溶液和盐酸的反应是___(吸热或放热)反应;
④Na2CO3 的饱和溶液和盐酸的反应是____(吸热或放热)反应;
⑤NaHCO3 固体与稀盐酸反应的反应热是由_____(填①~⑤序号)的热效应之和。