题目内容
【题目】(1)金属铁及其化合物在生产生活中有极其广泛的应用。
①高铁酸钠(化学式Na2FeO4)是一种含铁元素的新型绿色消毒剂,主要用于饮用水处理。此化合物中铁元素的化合价为_____。
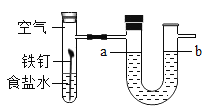
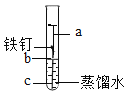
②小雪同学在探究铁生锈条件的实验时,按图装置进行实验,一周后发现铁钉锈蚀最严重的位置是_____处(从“a”“b”“c”中选择之一),取出铁钉后,她用盐酸除去表面的铁锈(主要成分为Fe2O3),发生反应的化学方程式为_____。
(2)我国海岸线长达3.2万千米。海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大。海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素。KCl和KNO3的溶解度曲线如图所示,试回答下列问题:
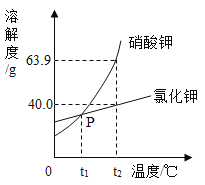
①t2℃时,硝酸钾的溶解度_____氯化钾的溶解度(填“大于”“等于”“小于”之一)。
②将t2℃时氯化钾的饱和溶液70g稀释成溶质质量分数为20%的氯化钾溶液。需加水_____g。
③将t1℃时硝酸钾饱和溶液和氯化钾饱和溶液分别升温至t2℃,此时硝酸钾溶液的溶质质量分数_____氯化钾溶液的溶质质量分数(选填"大于”“等于”“小于”“无法确定之一)。
【答案】+6 b ![]() 大于 30 等于
大于 30 等于
【解析】
根据化合价的计算、铁生锈的条件、酸的性质及化学方程式的书写、溶解度曲线的应用和溶质的质量分数分析作答。
(1)①设化学式Na2FeO4中铁元素的化合价为x,已知Na的化合价为+1价,O的化合价为-2价,根据化合物中正负化合价的代数和为零列出计算式:![]() ,解得x= +6;
,解得x= +6;
②小雪同学在探究铁生锈条件的实验时,一周后发现铁钉锈蚀最严重的位置是b处,因为b是同时接触铁、水和氧气的量多,最有利反应的进行;用盐酸除去表面的铁锈(主要成分为Fe2O3),发生反应的化学方程式是![]() ;
;
(2)①由图像知道t2℃时,硝酸钾的溶解度大于氯化钾的溶解度;
②t2℃时氯化钾的溶解度是40g,70g饱和溶液中的溶质质量是:![]() ,设加入水的质量为y,根据稀释前后溶质的质量不变有:
,设加入水的质量为y,根据稀释前后溶质的质量不变有:![]() ,解得y=30g;
,解得y=30g;
③t1℃时硝酸钾和氯化钾的溶解度相等,则它们的饱和溶液中溶质的质量分数相等,分别升温至t2℃,两溶液都变成了不饱和溶液,原有的溶质和溶剂的质量不变,所以此时硝酸钾溶液的溶质质量分数等于氯化钾溶液的溶质质量分数。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】已知 Na2CO3与 HCl 反应分两步进行:
第一步 Na2CO3与 HCl 反应生成 NaHCO3:![]() ;
;
第二步 NaHCO3 与 HCl 反应生成 CO2:![]() 。
。
现有这样一个实验:在两支试管中分别加入 3mL 稀盐酸,将两个各装有 0.3g NaHCO3 或 Na2CO3 粉末的小气球分别套在两支试管口,将气球内的NaHCO3或 Na2CO3 同时倒入试管中(反应中盐酸足量)。观察到现象如下:
(1)盛________的试管中产生气体的速率要快得多。
(2)盛_________的试管中气球变得更大,大小气球中生成气体的质量之比为(填最简单整数比)_____。
(3)甲同学用手触摸试管,发现盛 NaHCO3 粉末的试管变冷,而盛 Na2CO3的试管温度有升高。为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做 3 次平行实验,取平均值):
序号 | 试剂 1 | 试剂 2 | 混合前温度 | 混合后温度 |
① | 35mL 水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL 水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液 32.5mL | 20℃ | 19℃ |
④ | 35mL 稀盐酸 | 含 3.2g Na2CO3的饱和溶液 23.1mL+10ml 水 | 20℃ | 24.2℃ |
⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出五条结论:
①NaHCO3 的溶解是__(吸热或放热)过程;
②Na2CO3 的溶解是____(吸热或放热)过程;
③NaHCO3 的饱和溶液和盐酸的反应是___(吸热或放热)反应;
④Na2CO3 的饱和溶液和盐酸的反应是____(吸热或放热)反应;
⑤NaHCO3 固体与稀盐酸反应的反应热是由_____(填①~⑤序号)的热效应之和。