题目内容
【题目】某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种,某科学兴趣小组为探究其成分,设计了如图实验流程(所加试剂均足量)
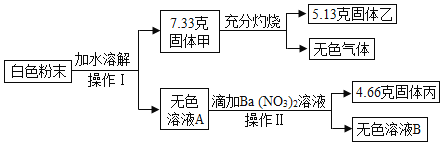
(1)操作Ⅰ、Ⅱ的名称是______;
(2)无色气体的质量是______克;
(3)固体甲的成分是______;
(4)这种白色粉末中一定不含有______;
(5)白色粉末可能含有______。
【答案】过滤 2.2 碳酸钙和硫酸钡 硫酸铜 氯化钠
【解析】
硫酸铜在溶液中显蓝色,碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,硫酸根离子和钡离子反应会生成硫酸钡沉淀。
(1)白色固体加水溶解经过操作I,得到了固体甲和溶液A,加入硝酸钡后经过操作II得到了溶液B和固体丙,所以操作Ⅰ、Ⅱ都是分离固体和液体,名称是:过滤;
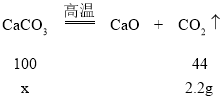
(2)7.33g的固体甲,充分灼烧得到了5.13g的固体乙和无色气体,所以无色气体的质量是:7.33g-5.13g=2.2g;
(3)固体甲加过经过加热灼烧,得到了固体乙和无色气体二氧化碳,所以固体甲中一定含有碳酸钙,
解:设产生2.2g二氧化碳气体需要分解碳酸钙的质量为x。
![]()
x=5g,固体甲的质量为7.33g,大于5g;则固体甲一定还有硫酸钡;
(4)白色固体加水溶解,过滤后,得到无色溶液,所以这种白色粉末中一定不含有硫酸铜,硫酸铜溶液是蓝色的;
(5)白色粉末不能确定氯化钠是否存在,可能含有氯化钠。

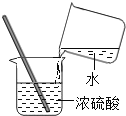
【题目】某化学兴趣小组在实验室实验时发现一瓶标签缺损的溶液,如图,为了确定其溶质成分,同学们进行了如下探究:
(提出猜想)
猜想一:NaCl;
猜想二:Na2CO3;
猜想三:NaHCO3;
猜想四:NaOH。
(设计实验一)小明取少量溶液样品于试管中 ,用玻璃棒蘸取溶液滴在pH试纸上,读取数据:pH=9,得出结论:猜想四成立。
小王认为小明的结论不准确,理由是___________________。从小明的实验结果中可以判断猜想____一定是错误的。
(设计实验二)小红取适量稀盐酸于试管中,滴加少量此溶液,溶液中产生气泡。于是认为猜想二正确。小王认为仍然不能确定,理由是______________ (用化学方程式解释)
(查阅资料)常温下,碳酸钠和碳酸氢钠溶解度如下表:
物质 | 碳酸钠 | 碳酸氢钠 |
溶解度/g | 21.8 | 9.6 |
(分析结论)
从资料显示的数据,再结合药品的标签可以判断猜想三不正确,理由是______________________。
(交流讨论)
(1)碳酸钠和碳酸氢钠在生活中被称为“苏打兄弟”,其中NaHCO3在生活中可用来___________(写一条即可)
(2)碳酸钠在空气中长期放置,会吸收空气中的水蒸气和另一种气体而转变成碳酸氢钠,另一种气体是_____________。