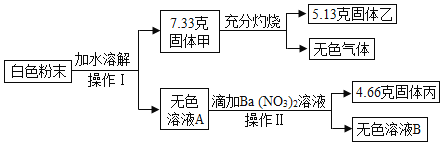
题目内容
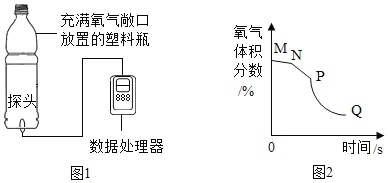
【题目】正确的化学实验操作对实验结果、人身安全非常重要。下图中的实验操作正确的是( )
A.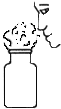 闻气体气味B.
闻气体气味B.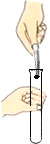 取用块状固体
取用块状固体
C.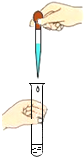 滴加液体D.
滴加液体D.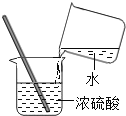 稀释浓硫酸
稀释浓硫酸
【答案】C
【解析】
A、闻气体的气味时,为了防止气体有毒,应用手扇动,不能直接用鼻子闻。操作错误,故选项错误;
B、取用块状固体时,先将试管横放,用镊子把固体放在试管口,再让试管慢慢地竖起来。图中操作错误,故选项错误;
C、使用胶头滴管滴加少量液体的操作,注意胶头滴管的位置是否伸入到试管内或接触试管内壁。应垂直悬空在试管口正上方滴加液体,防止污染胶头滴管,故选项正确;
D、稀释浓硫酸时,图中水注入到硫酸里面操作错误,应沿烧杯内壁将浓硫酸缓缓加入水中,否则会溅出伤人,故选项错误。
故选:C。

练习册系列答案
相关题目