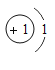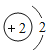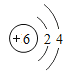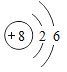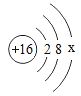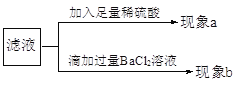题目内容
【题目】(1)请你参与下列探究:某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
(提出猜想)从元素守恒的角度,放出的气体可能是SO2、O2、H2.
(查阅资料)SO2易溶于水,它能与NaOH反应生成Na2SO3.
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
①甲同学认为是O2,则检验方法是______。
②乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式______。
③实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。如果放出的是O2和H2,你认为方案中的安全隐患是______,产生此隐患的原因:______(用方程式解释)。
老师说:“化学反应中,一种元素的化合价升高,肯定有元素的化合价降低,这是科学规律”.丙同学根据老师这句话分析判断:放出的气体肯定不是______。
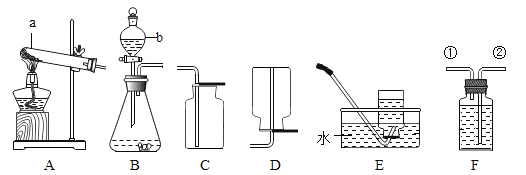
(实验探究)小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色,B装置的尾部有水珠生成;停止通气,再次称量装置A,发现质量无增减。结论:铁粉与硫酸铜溶液反应时,产生的气体是______。写出B装置中发生化学反应的方程式______。
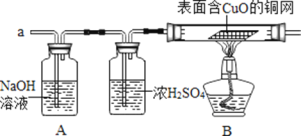
(2)某同学模仿物理课上学到的“串联电路”设计了如下气体制取与性质验证的组合实验.打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中,请看图回答问题。
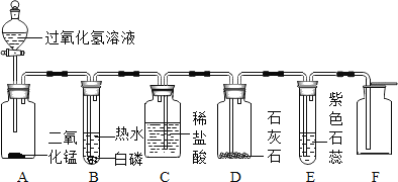
①A中发生反应的化学方程式为______。
②B中白磷能够燃烧的原因是______。
③E中的实验现象是______。
④用F装置收集气体的依据是______。
【答案】用带火星的木条试验,木条复燃则是氧气 ![]() 实验时易发生爆炸事故
实验时易发生爆炸事故 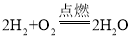 氧气 氢气
氧气 氢气 ![]()
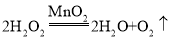 白磷的温度达到着火点,与氧气接触 溶液由紫色变红色 气体密度比空气密度大
白磷的温度达到着火点,与氧气接触 溶液由紫色变红色 气体密度比空气密度大
【解析】
方案设计:①氧气具有助燃性,能使带火星的木条复燃,氧气的检验方法是:用带火星的木条,能够复燃说明是氧气;
②SO2与NaOH反应生成亚硫酸钠和水,反应的化学方程式为:![]() ;
;
③如果放出的是O2和H2,氢气具有可燃性,混有一定量的氧气,加热时会发生爆炸,故方案中的安全隐患是:实验时易发生爆炸事故;
氢气与氧气急速燃烧,发生爆炸,生成水,该反应的化学方程式为: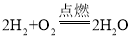 ;
;
根据化学反应中,一种元素的化合价升高,肯定有元素的化合价降低,若生成气体为氧气,O元素化合价升高,则必定还有H或S元素化合价降低,因此,所得气体肯定不能是氧气;
实验探究:含CuO的铜网由黑色变为光亮的红色,B装置的尾部有水珠生成,说明有还原性气体即氢气生成,氢气与氧化铜在加热的条件下反应生成铜和水,装置A质量无增减,说明无二氧化硫生成,故铁与硫酸铜溶液反应生成的气体是氢气;
装置B中发生的反应为氧化铜与氢气在加热的条件下反应生成铜和水,该反应的化学方程式为:![]() ;
;
(2)①过氧化氢在二氧化锰的催化下分解为氧气和水,该反应的化学方程式为: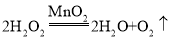 ;
;
②燃烧的条件是:(1)可燃物 (2)氧气(或空气)(3)达到燃烧所需的最低温度(也叫着火点),故B中白磷能够燃烧的原因是白磷的温度达到着火点,与氧气接触;
③氧气流进入C,使C内压强增大,把盐酸压入D和石灰石反应生成二氧化碳,二氧化碳气体进入E,与水反应生成碳酸,碳酸显酸性,紫色石蕊遇酸变红色,故E中的实验现象是:溶液由紫色变为红色;
④F装置是向上排空气法收集气体,适合收集密度比空气大的气体,故收集气体的依据是气体密度比空气密度大。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】化学小组进行如图所示实验:将稀盐酸、稀硫酸分别加入到装有少量氧化铜粉末的试管甲、乙中,微热,观察到黑色固体完全溶解,试管甲中的溶液显绿色,试管乙中的溶液显蓝色。激发了他们的兴趣,进行如下探究活动。
(1)写出氧化铜与稀盐酸反应的化学方程式______。
探究一:为什么CuCl2溶液显绿色而CuSO4溶液显蓝色?
(查阅资料)
氯化铜溶液与硝酸银溶液反应的化学方程式为:CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
(猜想与假设)①硫酸铜溶液显蓝色与硫酸根离子有关;
②氯化铜溶液显绿色与氯离子有关。
(实验1)
(2)取少量氧化铜粉末于试管中,加入一定量的稀硝酸,加热,观察到黑色固体完全溶解,溶液显______色,说明硫酸铜溶液显蓝色与硫酸根离子无关,与铜离子有关。
(实验2)
(3)小组的操作:取试管乙中的溶液滴加一定量的______,观察到溶液由蓝色变绿色,则猜想②成立。
(4)请你再设计一个实验证明猜想②成立。实验方案:取试管甲中的溶液,______(请简述实验操作与现象)。
探究二:氯化铜溶液显绿色是否与溶液的浓度有关。
(实验3)
步骤Ⅰ. 用托盘天平称取无水氯化铜固体5.0 g置于小烧杯中;
步骤Ⅱ. 往小烧杯中加入一定量的蒸馏水,搅拌,观察溶液的颜色并记录。
室温下的实验现象及数据记录如下表:
加入水的体积/mL | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
溶液颜色 | 深绿 | 墨绿 | 墨绿 | 蓝绿 | 绿色 | 深蓝 | 蓝色 | 蓝色 | 浅蓝 | 淡蓝 |
(5)上述实验可以得到的结论是______。
(6)仅从上述实验数据判断,为配制蓝色的氯化铜溶液,其溶液中溶质质量分数不超过______(数据精确到0.1%)。
探究三:氯化铜溶液显绿色是否与溶液的温度有关。
(实验4)
化学小组同学利用数字化技术研究温度对溶液颜色的影响。取50 mL溶质质量分数为10%的氯化铜蓝色溶液作为待测液,用色度计测定其透光率,绘出如图(透光率越小,溶液颜色越深,透光率越大,溶液颜色越浅)。
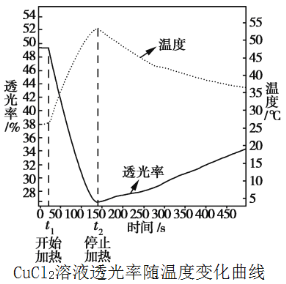
(7)上述实验结果表明:加热过程中,氯化铜溶液的颜色______(填“变深”、“变浅”或“不变”)。
【题目】在“宏观一微观一符号”之间建立联系,是化学特有的思维方式。
(1)下表为部分元素的原子结构示意图:
元素名称 | 氢 | 氦 | 碳 | 氧 | 钠 | 硫 |
元素符号 | H | He | C | O | Na | S |
原子结构示意图 |
|
|
|
|
|
|
请回答下列问题:
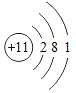
①表中硫原子结构示意图中,最外层电子数x=_____;
②原子的核外电子排布,特别是最外层的电子数目,与元素的性质有密切的关系。表中具有相对稳定结构的原子是_____(填元素符号);
③在化学反应中,如果有元素化合价升高,则一定有元素化合价降低,这样的反应叫做氧化还原反应。在四种基本化学反应类型中,_____反应一定不是氧化还原反应;在NaH与水反应中,只有一种元素的化合价发生改变,生成物除NaOH外,另一种产物的化学式是_____。
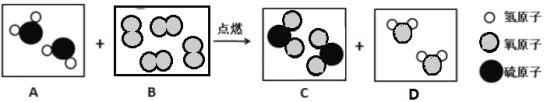
(2)汽车尾气催化转换器可减少有害气体排放,其反应过程的微观变化如图:
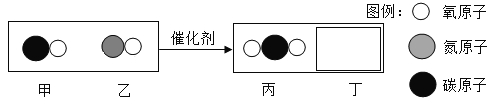
①已知丁是一种单质,则丁是_____(写化学式);
②根据以上微观示意图得出的结论中,正确的有_____。(填字母序号)
A 该反应中含氧元素的物质有3种
B 该反应是置换反应
C 参加反应的甲和乙的质量比为14:15
D 生成丙和丁的分子个数比为2:1