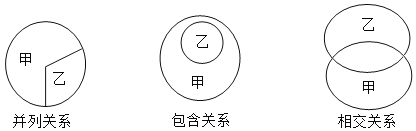
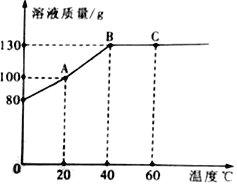
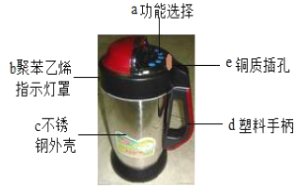
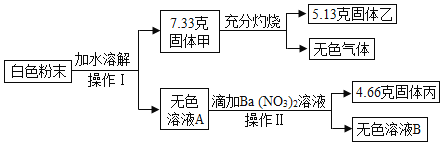
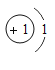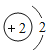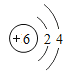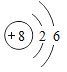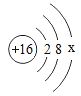题目内容
【题目】初三(112)班的小敬同学将22.5g的大理石(杂质不参加反应,也不溶于水)放到盛有100g稀盐酸的烧杯中,发现两者恰好完全反应。反应后烧杯内物质的总质量为118.1g, 请你帮他计算: (反应的方程式: ![]() )
)
(1)生成二氧化碳_____g。
(2)所用100g稀盐酸中溶质的质量分数。_____(写出计算过程)
【答案】4.4 7.3%
【解析】
(1)由题意二氧化碳逸出烧杯,反应前后质量的减少量即为生成的二氧化碳的质量,则生成二氧化碳的质量为22.5g+100g-118.1g=4.4g。
(2)设生成4.4gCO2需要的氯化氢的的质量为x,则有:
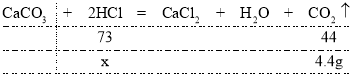
由![]() 解得x=7.3g
解得x=7.3g
则稀盐酸中溶质的质量分数为![]()
答:稀盐酸中溶质的质量分数为7.3%。

【题目】化学小组进行如图所示实验:将稀盐酸、稀硫酸分别加入到装有少量氧化铜粉末的试管甲、乙中,微热,观察到黑色固体完全溶解,试管甲中的溶液显绿色,试管乙中的溶液显蓝色。激发了他们的兴趣,进行如下探究活动。
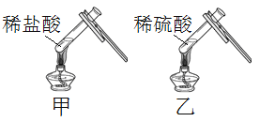
(1)写出氧化铜与稀盐酸反应的化学方程式______。
探究一:为什么CuCl2溶液显绿色而CuSO4溶液显蓝色?
(查阅资料)
氯化铜溶液与硝酸银溶液反应的化学方程式为:CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
(猜想与假设)①硫酸铜溶液显蓝色与硫酸根离子有关;
②氯化铜溶液显绿色与氯离子有关。
(实验1)
(2)取少量氧化铜粉末于试管中,加入一定量的稀硝酸,加热,观察到黑色固体完全溶解,溶液显______色,说明硫酸铜溶液显蓝色与硫酸根离子无关,与铜离子有关。
(实验2)
(3)小组的操作:取试管乙中的溶液滴加一定量的______,观察到溶液由蓝色变绿色,则猜想②成立。
(4)请你再设计一个实验证明猜想②成立。实验方案:取试管甲中的溶液,______(请简述实验操作与现象)。
探究二:氯化铜溶液显绿色是否与溶液的浓度有关。
(实验3)
步骤Ⅰ. 用托盘天平称取无水氯化铜固体5.0 g置于小烧杯中;
步骤Ⅱ. 往小烧杯中加入一定量的蒸馏水,搅拌,观察溶液的颜色并记录。
室温下的实验现象及数据记录如下表:
加入水的体积/mL | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
溶液颜色 | 深绿 | 墨绿 | 墨绿 | 蓝绿 | 绿色 | 深蓝 | 蓝色 | 蓝色 | 浅蓝 | 淡蓝 |
(5)上述实验可以得到的结论是______。
(6)仅从上述实验数据判断,为配制蓝色的氯化铜溶液,其溶液中溶质质量分数不超过______(数据精确到0.1%)。
探究三:氯化铜溶液显绿色是否与溶液的温度有关。
(实验4)
化学小组同学利用数字化技术研究温度对溶液颜色的影响。取50 mL溶质质量分数为10%的氯化铜蓝色溶液作为待测液,用色度计测定其透光率,绘出如图(透光率越小,溶液颜色越深,透光率越大,溶液颜色越浅)。
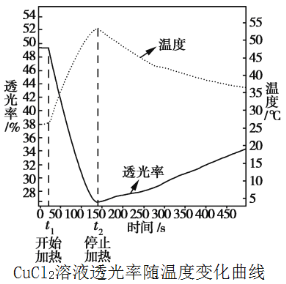
(7)上述实验结果表明:加热过程中,氯化铜溶液的颜色______(填“变深”、“变浅”或“不变”)。
【题目】在“宏观一微观一符号”之间建立联系,是化学特有的思维方式。
(1)下表为部分元素的原子结构示意图:
元素名称 | 氢 | 氦 | 碳 | 氧 | 钠 | 硫 |
元素符号 | H | He | C | O | Na | S |
原子结构示意图 |
|
|
|
|
|
|
请回答下列问题:
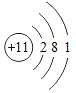
①表中硫原子结构示意图中,最外层电子数x=_____;
②原子的核外电子排布,特别是最外层的电子数目,与元素的性质有密切的关系。表中具有相对稳定结构的原子是_____(填元素符号);
③在化学反应中,如果有元素化合价升高,则一定有元素化合价降低,这样的反应叫做氧化还原反应。在四种基本化学反应类型中,_____反应一定不是氧化还原反应;在NaH与水反应中,只有一种元素的化合价发生改变,生成物除NaOH外,另一种产物的化学式是_____。
(2)汽车尾气催化转换器可减少有害气体排放,其反应过程的微观变化如图:
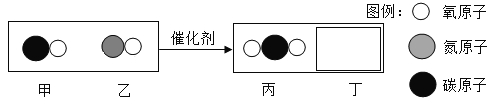
①已知丁是一种单质,则丁是_____(写化学式);
②根据以上微观示意图得出的结论中,正确的有_____。(填字母序号)
A 该反应中含氧元素的物质有3种
B 该反应是置换反应
C 参加反应的甲和乙的质量比为14:15
D 生成丙和丁的分子个数比为2:1