题目内容
某化学兴趣小组的同学对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示.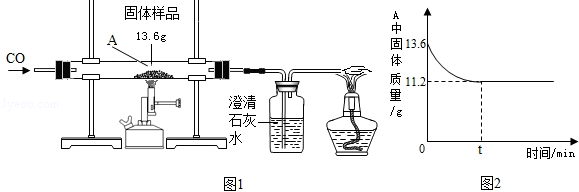
请计算:
(1)固体样品中氧化铁的质量是 克.
(2)在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
(1)8 (2)22.9%
解析试题分析:(1)设氧化铁的质量为x,则
3CO+Fe2O3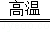 2Fe+3CO2 固体减重
2Fe+3CO2 固体减重
160 112 160﹣112=48
x (13.6g﹣11.2 g)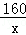 =
=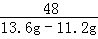
解得x=8g
(2)设生成的FeCl2和H2质量分别为x、y,则
Fe+2HCl=FeCl2+H2↑
56 127 2
11.2g x y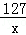 =
= =
=
解得x=25.4g;y=0.4g ×100%=22.9%.
×100%=22.9%.
答:(1)8;(2)所得溶液中溶质的质量分数为22.9%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题考查关于化学反应式的计算,需要同学们能够准确的书写化学反应式,理清物质间的关系,才可做出准确的计算.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案某环保小组监测到化工厂排放的废水中含有盐酸和氯化镁两种污染物,为测定该废水中各污染物的含量,环保小组进行了以下实验:
【实验一】取废水100g,向其中加入溶质质量分数为10%的氢氧化钠溶液。测得沉淀质量与所加入氢氧化钠溶液质量的关系如图。请根据实验及有关数据分析和计算: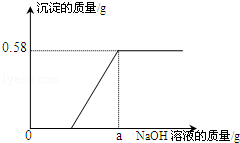
(1)向100g该废水中加入足量的氢氧化钠溶液时,产生的沉淀质量为 g。
(2)求该废水中氯化镁溶质的质量分数是多少?
【实验二】取三份废水各100g,分别缓慢加入到20g、40g和60g某硝酸银溶液中,测得三组实验数据见下表:
| | 第一组 | 第二组 | 第三组 |
| 硝酸银溶液的质量/g | 20 | 40 | 60 |
| 生成沉淀的质量/s | 2.870 | 5.740 | 7.175 |
(3)100g废水中加入硝酸银溶液的质量为 g时,可恰好完全反应。
(4)【实验一】图示中,a的数值为 。
常温下,某气体无色、无味、无毒、能溶于水,密度比空气大。如果在实验室里采用固体和液体接触反应且不需要加热制备该气体,则应选择的发生装置和收集装置是 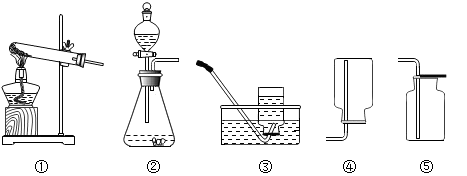
| A.②和③ | B.①和③ | C.②和④ | D.②和⑤ |