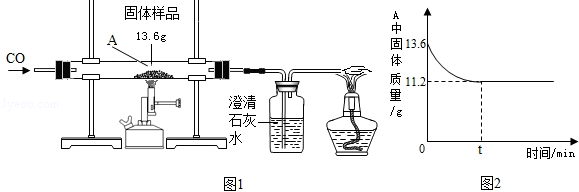
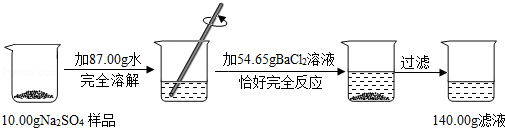
题目内容
将氢氧化钠固体投入到200.0g一定溶质质量分数的稀硫酸中,恰好完全反应,所得溶液的质量为208.0g.请计算所用稀硫酸的溶质质量分数.
4.9%
解析试题分析:由质量守恒定律可知,参加反应的氢氧化钠的质量为208.0g﹣200g=8g
设稀硫酸中溶质的质量x
H2SO4 +2NaOH=2H2O+Na2SO4
98 80
x 8g 解得:x=9.8g
解得:x=9.8g
所用稀硫酸的溶质质量分数为: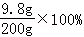 =4.9%
=4.9%
答:所用稀硫酸的溶质质量分数为4.9%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题主要考查学生运用化学方程式进行计算的能力,掌握相关的溶液及化学方程式基本计算是解题的关键所在.

练习册系列答案
相关题目
小黄同学为了测定某混合物(Na2CO3与NaOH混合)中碳酸钠的质量分数,进行了如下实验:称取了20g样品配成溶液,然后逐渐加入一定量质量分数为20.8%的BaCl2溶液(已知:Na2CO3+BaCl2=2NaCl+BaCO3↓),充分反应.在此过程中他进行了三次数据测定,结果如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 |
| 加入BaCl2溶液的质量/g | 60 | 120 | 150 |
| 生成沉淀的质量/g | 11.82 | 19.7 | 19.7 |
(1)第一次测定数据后所得溶液中含有溶质是NaOH, (填化学式);
(2)此实验中,实际参加反应的BaCl2溶液的质量为 ;
(3)样品中碳酸钠的质量分数为多少?(写出计算过程)
利用下图所示装置,能完成实验室制取气体的是( )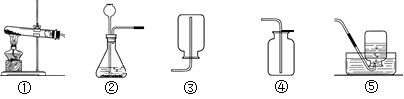
| A.用①③制取氧气 | B.用②③制取二氧化碳 |
| C.用②④制取氧气 | D.用①⑤制取二氧化碳 |
 NaNO3+H2O+NH3↑;
NaNO3+H2O+NH3↑;