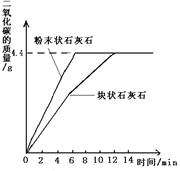
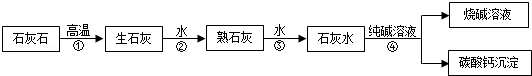
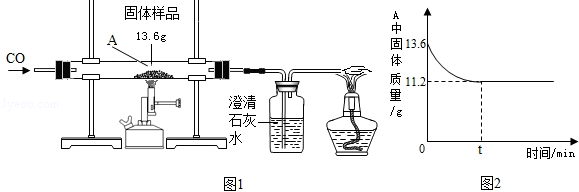
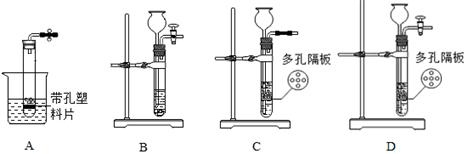
题目内容
称取铜、锌混合物10克置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49克稀硫酸,剩余固体3.5克,
(1)该混合物中铜的质量分数是多少?
(2)所用的稀硫酸溶质的质量分数是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
(1)35% (2)20% (3)29.1%
解析试题分析:(1)混合物中铜的质量分数为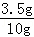 ×100%=35%
×100%=35%
(2)固体中的锌的质量是10g﹣3.5g=6.5g;
设稀硫酸中溶质的质量分数为x.生成硫酸锌的质量是y,生成硫酸锌的质量是z
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
6.5g 49g×x z y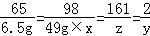
x=20% y=0.2g z=16.1g
(3)所得溶液的质量为49g+6.5g﹣0.2g=55.3g,所以所得溶液的溶质质量分数为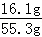 ×100%=29.1%;
×100%=29.1%;
答:(1)混合物中铜的质量分数为35%.(2)稀硫酸中溶质的质量分数为20%.(3)反应后所得溶液中溶质的质量分数是29.1%
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:根据金属的活动性,分析题中所发生的反应,判断出所余固体为铜,此为本题的突破口.

工业上侯氏制碱法得到的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验.在实验室中取27g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表:
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是 g.
(2)计算纯碱样品中碳酸钠的质量分数是多少?(计算结果精确到0.1%)
(3)计算所用稀盐酸的质量分数是多少?
小黄同学为了测定某混合物(Na2CO3与NaOH混合)中碳酸钠的质量分数,进行了如下实验:称取了20g样品配成溶液,然后逐渐加入一定量质量分数为20.8%的BaCl2溶液(已知:Na2CO3+BaCl2=2NaCl+BaCO3↓),充分反应.在此过程中他进行了三次数据测定,结果如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 |
| 加入BaCl2溶液的质量/g | 60 | 120 | 150 |
| 生成沉淀的质量/g | 11.82 | 19.7 | 19.7 |
(1)第一次测定数据后所得溶液中含有溶质是NaOH, (填化学式);
(2)此实验中,实际参加反应的BaCl2溶液的质量为 ;
(3)样品中碳酸钠的质量分数为多少?(写出计算过程)