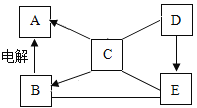
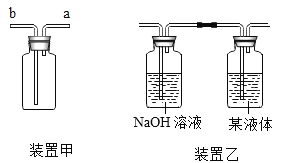
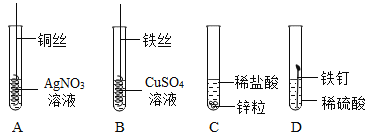
题目内容
【题目】根据下列实验装置图,请回答问题。
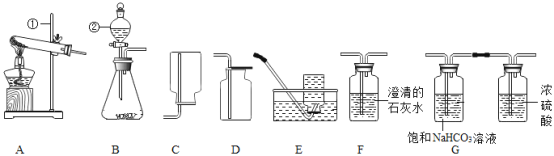
(1)写出标有① ②序号的仪器名称:①______,②_______。
(2)实验室用石灰石和稀盐酸制取二氧化碳时,发生装置是_____,检验二氧化碳应选用的装置是___,该装置内发生反应的化学方程式为_____________。
(3)若要收集一瓶干燥纯净的二氧化碳,所选装置正确的连接顺序是气体发生装置→__→___(选填装置字母序号)。
【答案】铁架台 分液漏斗 B F ![]() G D
G D
【解析】
(1)仪器①的名称为铁架台;仪器②的名称为分液漏斗。
(2)实验室用石灰石和稀盐酸制取二氧化碳时,不需加热,故选用的发生装置为B;检验二氧化碳应将气体通入澄清石灰水,故选用的装置是F;发生的反应为二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为![]() 。
。
(3)若要收集一瓶干燥纯净的二氧化碳,先选用气体发生装置,然后除去气体中含有的氯化氢和水,故选用G进行除杂,最后因为二氧化碳气体密度比空气大且能溶于水,选用向上排空气法进行收集,故选用D装置进行收集。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案【题目】某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测定反应前后各物质的质量如表,根据表中信息,判断下列说法正确的是( )
物质 | X | O2 | CO2 | H2O |
反应前质量/g | 23 | 70 | 1 | 0 |
反应后质量/g | 0 | 待测 | 45 | 27 |
A.该反应为分解反应
B.反应生成的CO2和H2O的质量比为45:27
C.表中“待测”值为48
D.X中一定含有碳、氢、氧三种元素
【题目】NaHCO3在生产和生活中有许多重要用途,某学习小组对其性质进行了如下探究。物质的溶解度见下表。回答下列问题:
温度 | 10℃ | 20℃ |
NaHCO3的溶解度(g/100g水) | 8.1 | 9.6 |
Ca(HCO3)2的溶解度(g/100g水) | 16.6 |
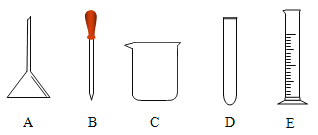
(1)在20℃时称取4gNaHCO3加入46mL蒸馏水(密度取值为lg/mL),充分搅拌制得澄清溶液。该实验可以达到探究NaHCO3____性的目的;实验中不需要的仪器是___(选填字母编号)。
(2)用pH计测得溶液的pH为8.2,说明溶液呈_______性。
(3)所配NaHCO3溶液的质量分数等于_____,降温到10℃时溶液___(填“是”或“不是”)饱和溶液
(4)取2mL所配NaHCO3溶液于试管中,滴加5%的CaCl2溶液,观察到气泡和白色沉淀,实验证明该气体是CO2。据此小组同学讨论认为:白色沉淀不可能是Ca(OH)2,其理由是_____,于是得出结论:白色沉淀是___。