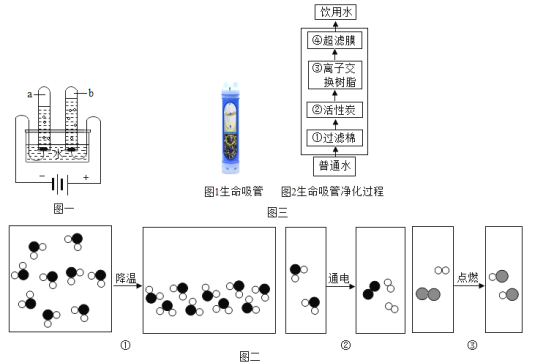
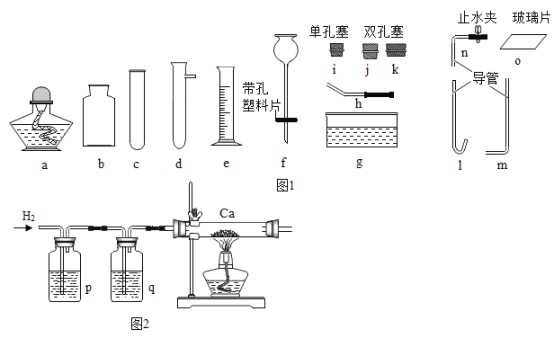
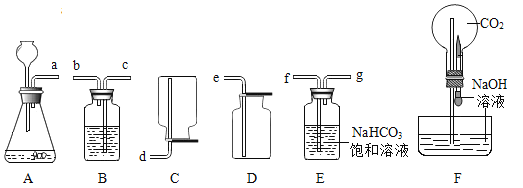
��Ŀ����
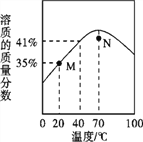
����Ŀ������г���KNO3��NaCl�ڲ�ͬ�¶�ʱ���ܽ�ȣ�
�¶ȣ����� | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
KNO3�ܽ�ȣ�g�� | 13.3 | 20.9 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl�ܽ�ȣ�g�� | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
���к�123g KNO3��17.9g NaCl�Ļ���ijͬѧ���������ʵ���ȥKNO3�е�NaCl��
���������м�������ˮ�������ܽ⣻
�ڼ���������Һ��100������������Ũ��������ص��ȱ�����Һ��
�۽���Һ������10�������õ�KNO3���壬���ˣ�������KNO3����ϴ�Ӳ����
��1���ڲ�����У�Ϊȷ��û�о�����������Һ������Ҫ����_____gˮ
��2���ڲ�����У����ɵõ�KNO3����_____g
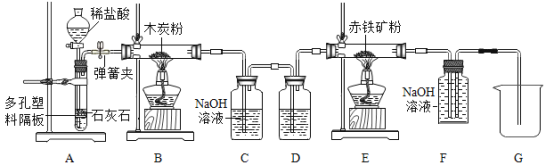
��3����ȥKNO3������NaCl����Ҫʵ�����̿�����ͼ��ʾ��
![]()
������ȱ�ٵIJ�����_____��
��4��ϴ��ʱ��Ӧѡ������_____��ѡ������ˮ��������ˮ������֤���Ѿ�ϴ�Ӹɾ��ķ�����_____��
���𰸡�50 112.55 ���� ��ˮ ȡ���һ��ϴ��Һ�μ���������Һ�����ް�ɫ����������֤��ϴ�Ӹɾ�
��������
��1������100������غ��Ȼ��Ƶ��ܽ�Ƚ��з�����
��2������10������ص��ܽ�Ƚ��з�����
��3�����ݽ��º�����������з�����
��4����������ص��ܽ�����¶ȵĹ�ϵ���з�����
��1��100������ص��ܽ����246g������Ҫ�ܽ�123g�������Ҫ50gˮ��100���Ȼ��Ƶ��ܽ����39.8g���ܽ�17.9g�Ȼ�����ˮ44.97g������50gˮ�����о���������
��2��10������ص��ܽ����20.9g������50gˮֻ���ܽ⣺10.45g������������������Ϊ��123g��10.45g��112.55g��
��3�������ܽ�������Ũ�������º�������ܽ�ȼ�С�����������壬�ٽ��й��ˣ�ϴ�Ӹ��
��4��ϴ������ؾ���ʱҪ����ˮ���������Ϊ�¶ȸ�������ܽ�������ܽ�һ��������أ�֤���Ѿ�ϴ�Ӹɾ��ķ����ǣ�ȡ���һ��ϴ��Һ�μ���������Һ�����ް�ɫ����������֤��ϴ�Ӹɾ���

 ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�����Ŀ��(1)ʵ������ȡ������̼����ѧ��ѧ��һ����Ҫʵ��,ͬѧ�����Ƴ�������̼���ֽ�������ص�ϵ��ʵ��,ʵ��װ����ͼ:
��Bװ���з�Ӧ�Ļ�ѧ����ʽΪ_____________________��
����Aװ�������������ŵ���___________________��
��Cװ�õ�������__________________��Dװ�õ�������___________________��
��Eװ���з�����Ӧ��ʵ������Ϊ___________________��
��Fװ�ó�������CO2��,��������������___________________��
(2)�ڻ�ѧʵ��̽������,��ѧ��ʦ����ijѧϰС��һ����ɫ��ĩ,����ʾ�÷�ĩ��Na2SO4��NaNO2(��������)��NaCl �е�һ�ֻ�����ɡ���С��ͬѧ��̽���ð�ɫ��ĩ��ɵ�ʵ���������:
[��������]1��������������ˮ
2Na2SO4��NaNO2��NaCl�IJ����������:
��ѧʽ | ˮ��Һ������� | ��ϡ�������� | ���� |
NaNO2 | ���� | �����غ�ɫ���� | �� |
NaCl | ���� | ����Ӧ | �� |
Na2SO4 | ���� | ����Ӧ | �� |
[ʵ��̽��]
���������Լ�:����ˮ����̪��Һ���Ȼ�����Һ�����ᱵ��Һ����������Һ��ϡ���ᡢϡ����
���� | ʵ����� | ʵ������ | ʵ����� |
����һ | ȡ������ɫ��ĩ�����Թ��У�������ˮ�ܽ�,�μ�____________�� | ������ | ��ɫ��ĩ�в�����NaNO2 |
����� | ��ȡ������ɫ��ĩ�����Թ��У�������ˮ�ܽ⣬______________�� | _____________ | ��ɫ��ĩ�к���Na2SO4��NaCl |
������ | _______________ | _____________ |