题目内容
【题目】(1)实验室制取二氧化碳是中学化学的一个重要实验,同学们在制出二氧化碳后又进行了相关的系列实验,实验装置如图:
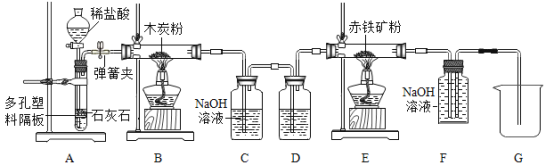
①B装置中反应的化学方程式为_____________________。
②用A装置制气体的最大优点是___________________。
③C装置的作用是__________________,D装置的作用是___________________。
④E装置中发生反应的实验现象为___________________。
⑤F装置除了吸收CO2外,还可以起到的作用是___________________。
(2)在化学实验探究课上,化学老师交给某学习小组一包白色粉末,并提示该粉末由Na2SO4、NaNO2(亚硝酸钠)、NaCl 中的一种或几种组成。该小组同学们探究该白色粉末组成的实验过程如下:
[查阅资料]1亚硝酸盐能溶于水
2Na2SO4、NaNO2、NaCl的部分性质如表:
化学式 | 水溶液的酸碱性 | 与稀盐酸作用 | 毒性 |
NaNO2 | 碱性 | 产生棕红色气体 | 有 |
NaCl | 中性 | 不反应 | 无 |
Na2SO4 | 中性 | 不反应 | 无 |
[实验探究]
限用以下试剂:蒸馏水、酚酞试液、氯化钡溶液、硝酸钡溶液、硝酸银溶液、稀盐酸、稀硝酸
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤一 | 取少量白色粉末加入试管中,加蒸馏水溶解,滴加____________。 | 无现象 | 白色粉末中不含有NaNO2 |
步骤二 | 另取少量白色粉末加入试管中,加蒸馏水溶解,______________。 | _____________ | 白色粉末中含有Na2SO4和NaCl |
步骤三 | _______________ | _____________ |
【答案】 可以控制反应的发生和停止 吸收未反应的二氧化碳 干燥气体 红棕色固体逐渐变成黑色固体 收集未反应的一氧化碳 酚酞试液(或稀盐酸) 加入过量的硝酸钡溶液,过滤 产生白色沉淀 可取步骤二的少量滤液于试管中,滴加少量硝酸银溶液和稀硝酸 产生白色沉淀
可以控制反应的发生和停止 吸收未反应的二氧化碳 干燥气体 红棕色固体逐渐变成黑色固体 收集未反应的一氧化碳 酚酞试液(或稀盐酸) 加入过量的硝酸钡溶液,过滤 产生白色沉淀 可取步骤二的少量滤液于试管中,滴加少量硝酸银溶液和稀硝酸 产生白色沉淀
【解析】
(1)①B装置中为A装置中碳酸钙与稀盐酸反应生成的二氧化碳与碳在高温的条件下反应生成一氧化碳,该反应的化学方程式为: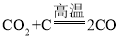 ;
;
②用A装置制气体的最大优点是:可以控制反应的发生和停止,关闭弹簧夹,通过分液漏斗添加稀盐酸,使固液接触,反应发生,生成二氧化碳,装置内压强增大,将稀盐酸压入分液漏斗中,固液分离,反应停止,打开弹簧夹,固液接触,反应发生;
③氢氧化钠能与二氧化碳反应生成碳酸钠和水,故C装置的作用是吸收未反应的二氧化碳,D装置的作用是:D装置可盛放浓硫酸,起到干燥气体的作用;
④赤铁矿的主要成分是三氧化二铁,B装置中生成的一氧化碳可与E装置中的三氧化二铁在高温下反应生成铁和二氧化碳,故发生反应的实验现象为:红棕色固体逐渐变成黑色固体;
⑤F装置除了吸收CO2外,还可以起到的作用是:收集未反应的一氧化碳;
实验探究:步骤一:实验结论为:白色粉末中不含有NaNO2,实验现象为无现象,由于NaNO2显碱性,其它盐显中性,与稀盐酸反应生成棕红色气体,故可取少量白色粉末加入试管中,加蒸馏水溶解,滴加酚酞试液(或稀盐酸),无现象,说明不含NaNO2;
步骤二:实验结论为:白色粉末中含有Na2SO4和NaCl,故另取少量白色粉末加入试管中,加蒸馏水溶解,加入过量的硝酸钡溶液,过滤,硝酸钡能与硫酸钠反应生成硫酸钡沉淀和硝酸钠,故实验现象为:产生白色沉淀;
步骤三:验证含有氯化钠:可取步骤二的少量滤液于试管中,滴加少量硝酸银溶液和稀硝酸,氯化钠能与硝酸银反应生成氯化银白色沉淀和硝酸钠,故实验现象为:产生白色沉淀。

【题目】小丽来到实验室,看到实验桌上有一瓶敞口放置的氢氧化钠固体,于是她对这瓶氢氧化钠固体的成分展开探究。
[提出问题]这瓶氢氧化钠固体是否变质?
[猜想假设]猜想一:没有变质,固体物质是NaOH;
猜想二:部份变质,固体物质是NaOH和Na2CO3;
猜想三:完全变质,固体物质是_____。
[实验探究]为了探究固体成分,他们分别进行了如下实验:
(1)写出氢氧化钠变质的化学方程式_____。
(2)为了进一步确定这瓶固体的成分,丙同学设计了如下方案,请你完成下列实验报告:
实验方案 | 实验步骤 | 实验的现象 | 实验结论 |
实验方案Ⅰ | 取样于试管中 ,加入过量稀盐酸。 | 出现大量气泡 | 说明猜想一不成立 |
实验方案Ⅱ | ①取样于试管中,加水溶解,滴入酚酞溶液 | 溶液变红色 | 说明猜想二成立 |
②向①反应后溶液,滴入过量的Ca(OH)2溶液 | 产生白色沉淀,溶液显_____色 | ||
实验方案Ⅲ | ①取样于试管中,加水溶解,滴入酚酞溶液 | 溶液变红色 | 说明猜想三成立。 |
②向①反应后溶液,滴入过量的CaCl2溶液 | 产生_____,溶液由红色变成无色 |
[反思和评价]
1、在设计的实验方案中,其中有一种不合理的方案是_____。
2、在实验方案Ⅲ的探究中,能代替CaCl2溶液进行实验的是_____。 (填序号)
①稀硝酸;②Ba(OH)2溶液:③Ba(NO3)2溶液;④K2CO3溶液: ⑤Ca(NO3)2 溶液
【题目】如表列出了KNO3与NaCl在不同温度时的溶解度:
温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
KNO3溶解度(g) | 13.3 | 20.9 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl溶解度(g) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
现有含123g KNO3与17.9g NaCl的混合物,某同学设计了以下实验除去KNO3中的NaCl。
①向混合物中加入适量水,加热溶解;
②继续加热溶液至100℃并恒温蒸发浓缩成硝酸钾的热饱和溶液;
③将溶液降温至10℃,仅得到KNO3晶体,过滤,将所得KNO3晶体洗涤并干燥。
(1)在步骤②中,为确保没有晶体析出,溶液中至少要保留_____g水
(2)在步骤③中,最多可得到KNO3晶体_____g
(3)除去KNO3中少量NaCl的主要实验流程可用如图表示:
![]()
方框中缺少的步骤是_____;
(4)洗涤时,应选用少量_____(选填“热水”或“冷水”);证明已经洗涤干净的方法是_____。