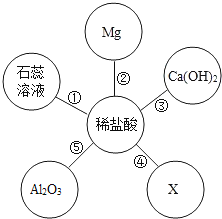
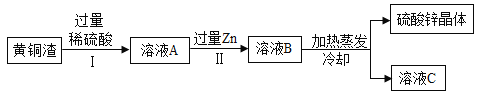
题目内容
【题目】根据如图所示的实验过程和所提供的数据计算(假设恰好完全反应)。
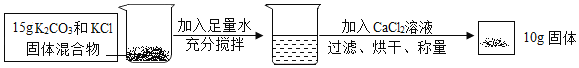
(反应的化学方程式为:K2CO3+CaCl2 ═CaCO3↓+2KCl)
(1)CaCl2中钙元素和氯元素的质量比为_____。
(2)样品中碳酸钾的质量分数(写出计算过程)。_____
(3)反应后所得溶液中氯化钾的质量(写出计算过程)。_____
【答案】40:71 92% 16.1g
【解析】
解:(1)CaCl2中钙元素和氯元素的质量比为40:(35.5×2)=40:71
(2)最后剩余的固体为碳酸钙,设样品中碳酸钾的质量为x,反应生成氯化钾的质量为y。
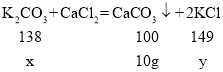
![]()
x=13.8 g y=14.9 g
样品中碳酸钾的质量分数=![]() ×100%=92%
×100%=92%
所得溶液中氯化钾的质量=(15g﹣13.8g)+14.9g=16.1g
答:(1)CaCl2中钙元素和氯元素的质量比为 40:71。
(2)样品中碳酸钾的质量分数为92%。
(3)反应后所得溶液中氯化钾的质量为16.1g。

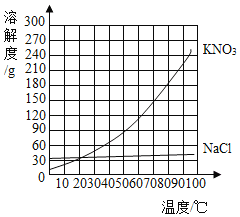
【题目】下表是![]() 、
、![]() 在不同温度时的溶解度。
在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g |
| 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| 13.3 | 31.6 | 63.9 | 110 | 169 | |
(1)50℃时,![]() 在水中的溶解度_____
在水中的溶解度_____![]() 在水中的溶解度(填“小于”“等于”或“大于”)。
在水中的溶解度(填“小于”“等于”或“大于”)。
(2)若将上表数据在坐标系中绘制成![]() 和
和![]() 的溶解度曲线,两条曲线的交点对应的温度范围是_____(填序号)。
的溶解度曲线,两条曲线的交点对应的温度范围是_____(填序号)。
A 0℃~20℃ B 20℃~40℃
C 40℃~60℃ D 60℃~80℃
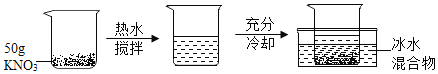
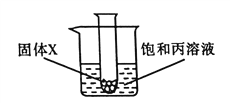
(3)某兴趣小组在盛有![]() 水的烧杯中逐步做以下如图实验。
水的烧杯中逐步做以下如图实验。
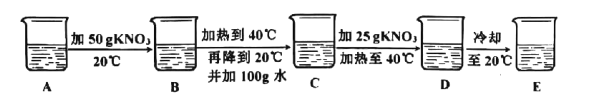
实验过程中,所得溶液的溶质质量分数一定相等的是span>_____(填序号),溶液D的质量是_____![]() .若将溶液
.若将溶液![]() 冷却到
冷却到![]() ,过滤,共可回收得到_____
,过滤,共可回收得到_____![]()
![]() 固体。向滤液中加入_____
固体。向滤液中加入_____![]() 水稀释,能得到1%的
水稀释,能得到1%的![]() 稀溶液,此溶液可作花肥使用。
稀溶液,此溶液可作花肥使用。