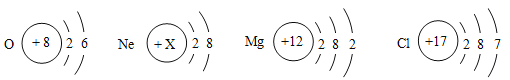��Ŀ����
����Ŀ���ס��ҡ������ֹ������ʵ��ܽ��������ͼ��ʾ����ش�

��1��0��ʱ�������������ܽ��������________��
��2��t2��ʱ����ʢ��50gˮ���ձ��м���35g�����ʣ���ֽ����������Һ��������_______g��
��3����t3��ļס��ҡ����������ʵı�����Һ���µ�t1��ʱ��������Һ�����ʵ�����������ϵΪ____________________���á�=����<����>���������ӣ���
��4��������Һ��A��ת��ΪB�㣬�ɲ��õķ�����_______����һ�ּ��ɣ���
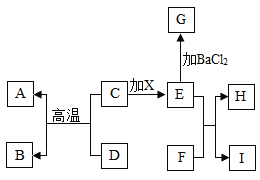
��5����ͼ�������й���X���Թܷ����ձ��У�Ȼ�����Թ��ڼ���Һ��Y��һ��ʱ������Һ���й������������Ӧ��X��Y������__________������ţ���
A���Ȼ��ƺ�ˮ
B��þ����ϡ����
C������狀�ˮ
D���������ƺ�ˮ
���𰸡� �� 80 ���� ��= �� �������ʻ������ܼ� BD
����������1�������ܽ�����߽��
��2������t2��ʱ�����ʵ��ܽ�Ƚ��
��3�������������ʵ��ܽ�����¶ȱ仯�����������Һ���������������ļ���ʽ�������
��4�����ݲ�������Һת��Ϊ������Һ�ķ������
��5�����ݱ����ʵ��ܽ�����¶ȵ����߶���С���
�⣺��1�����ܽ�����߿�֪��0��ʱ�������������ܽ�������DZ���
��2��t2��ʱ�����ʵ��ܽ����60g������100gˮ������ܽ�60g�����ʡ���ô��50gˮ������ܽ�30g�����ʡ���t2��ʱ����ʢ��50gˮ���ձ��м���35g�����ʣ���ֽ����������Һ��������80g��
��3����ͼ��֪���ס��ҵ��ܽ�����¶ȵ����߶������Ҽ��������¶ȵ�Ӱ��仯�ϴ����ܽ�����¶ȵ����߶���С�����Խ�t3��ʱ�ס��ҡ����������ʵı�����Һ���µ�t1��ʱ���ס����о�����������t1��ʱ�ס����ܽ����ȡ���ʱ�ס�����������������ȡ����������������������������䡣�ݱ���ʱ���������ļ���ʽ![]() ��100%����֪�ܽ��Խ����������Ҳ��Խ��t3��ʱ����������������������t1��ʱ�ס�������������������������Һ�����ʵ�����������ϵΪ���� ��= �ף�
��100%����֪�ܽ��Խ����������Ҳ��Խ��t3��ʱ����������������������t1��ʱ�ס�������������������������Һ�����ʵ�����������ϵΪ���� ��= �ף�
��4��������Һ��A��ת��ΪB�㣬�ǽ���������Һת��Ϊ������Һ���ɲ��õķ������������ʻ������ܼ���
��5�����ڱ����ʵ��ܽ�����¶ȵ����߶���С���������֪��һ��ʱ������Һ���й���������˵����ʱ��Һ�¶����ߣ��������ܽ�ȼ�С������˵������X��Y��Ϻ�ų�������A���Ȼ��ƺ�ˮ�¶Ȳ��䣻B��þ����ϡ���ᷴӦ�¶����ߣ�����Ҫ��C���������ˮ�¶Ƚ��ͣ�D��������������ˮ�¶����ߣ�����Ҫ���BD��

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ����С����ͬ������ϵ�д�
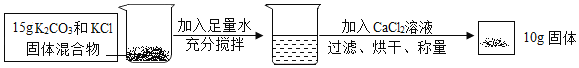
����С����ͬ������ϵ�д�����Ŀ����ҵ�ϣ����������������������������ߴ���ʳ�Σ��������Ƶ������ơ�±ˮ����Ҫ����NaCl������������Na2SO4��CaSO4��MgSO4��CaCl2��MgCl2��FeCl3���û����̵����е�CO2Ϊԭ�Ͼ���±ˮ�����ϵ�̼���÷�չҪ�������̣��ش����⣺
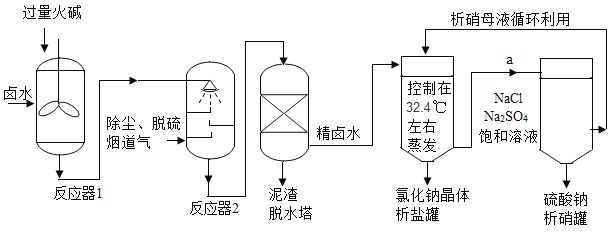
��1����Ӧ��1����Ҫ��ȥ��������_____������ţ���
��2���̵���ͨ�뷴Ӧ��2ǰҪ������Ϊ�˳�ȥ�к�����_____ ���ѧʽ������Ӧ��2�����ɳ����Ļ�ѧ����ʽ_____ ��дһ������
��3���±�ΪNaCl��Na2SO4�ڲ�ͬ�¶�ʱ���ܽ�ȣ�
�¶�/�� | 0 | 10 | 20 | 30 | 32.4 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
�ܽ��/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.4 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
4.9 | 9.1 | 19.5 | 40.8 | 52.0 | 48.8 | 46.2 | 45.3 | 44.3 | 43.7 | 42.7 | 42.5 |
�����ι����ų�����Һa�����¶Ȳ���������£�ÿ10gˮ�к���NaClԼ_____g��Ϊ���Na2SO4���ȣ�������������Na2SO4�������_____ �������������������������ᾧ������
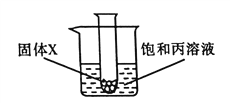
����Ŀ��С����ʵ�������������ʵ�飺������ȡ������������Ϊ30%���ܶ�Ϊ1.15gmL��1�Ľ�Ũ����40mL��46g����ˮ�������ϡ���ᣬ�ٸ�ʯ��ʯ��Ӧ�Ƶ����壬��������ͨ�����ʯ��ˮ����һֱδ�����dz��֡�Ϊ�ˣ�С�������ʦ����ʦ������ΪŪ��ԭ�����ʵ��̽������������̽���Ĺ��̣�����������������
��������⣩Ϊʲô�Ƶõ����岻��ʹʯ��ˮ����ǣ�
��������裩����һ������Ũ���Թ����������лӷ��������Ȼ�������
�����������ʯ��ˮ�Ѿ���ȫ����
��ʵ��̽����
ʵ����� | ʵ������ | ʵ����� |
������������ͨ��ϡ������������Ļ����Һ�� | ______ | ����һ��ȷ ��ѧ����ʽ______ |
����ȡ�������ó���ʯ��ˮ���Թ��У��μ�_____���� | ��Һ���ɫ | ���������ȷ |
���������ۣ�ԭ����������Ũ�ȴ�_____��Ӧ�������ٽ���ϡ�͡�
����˼��չ����С����ʵ��֤���˳���ʯ��ˮû����ȫ���ʣ����Dz�����˵������ʯ��ˮû�б��ʣ�������_____��
��������������̼�л��е������Ȼ������壬��ѡ�������Լ���_____������ĸ��ţ���
a����������Һ
bˮ
c���͵�̼��������Һ
d��������Һ
����Ŀ��ij��ѧС���ʯ��ʯ���պ�õ��Ĺ���������̽����
�ɷַ���
��1���������չ����в�����������
����������֪ʶ�;����жϣ�ʯ��ʯ���պ�����к���CaO���жϵ�������_____���û�ѧ����ʽ��ʾ����
�����ʵ�鷽��������֤��
ʵ������ | ʵ������ | ʵ����� |
ȡ���պ�������ʢ����ˮ���ձ��У���ֽ��農�ú�ȡ�����ϲ�����Һ�������Թ��У������еμ�2�η�̪��Һ | ��Һ����ɫ��Ϊ_____ɫ | ��Ӧ�����ɼ��д���÷�Ӧ�Ļ�ѧ����ʽ��_____ |
��2���������պ�������Ƿ���CaCO3
��ʢ�����պ������ձ��еμ�ϡ���ᣬ�����ݲ�����֤��_____��
���ݷ���
�÷�Ӧǰ��������������պ������CaCO3����������
��ѧС�������������ʵ�鷽���������з�Ӧǰ��������ֱ���m1��m2��ʾ������������ʵ����������Բ��ƣ�ȡ�õ����պ����ɷ־��ȡ�������ȣ������г�CaO��CaCO3����ɷ־���������Ӧ������ϡ���ᾭ����ȷ��������
ʵ�鷽�� | ���ݲ��� | ���ݴ��� | |
��Ӧǰ | ��Ӧ�� | ��Ӧǰ�������� | |
����һ��ȡ���պ��������ձ��У�����ϡ�����ַ�Ӧ�����ٲ������� | ���պ���������������ϡ�������� | �ձ���ʣ�����ʵ����� | m1 |
��������ȡ���պ����������գ���������������ٸı� | ���պ��������� | ʣ���������� | m2 |
�����Ϣ���Ƚ�m1��m2�Ĺ�ϵ����д�����ֲ�ͬ���벢�ֱ�˵�����ɡ�
����1�����ɣ�_____��
����2�����ɣ�_____��
������ѡ�������ʵ�鷽�������м��㡭��
��չ�о�
��ͼ�ľƾ��ƺ;ƾ�����dz��õļ�����������ش��������⣺
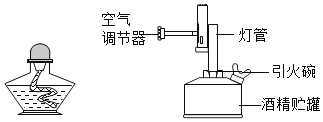
��1���ƾ����Dz��������������¶�ͨ���ɴ�300��500�棬_____������ġ��������桱�����桱���¶���ߡ�Ϩ��ƾ��Ƶķ�����_____�����ô˷�������ԭ����_____��
��2���ƾ����һ����ͭ�������������¶�ͨ���ɴ�800��1000�森ʹ�þƾ����ʱӦ������������ע��![]() �����ľƾ����û���������ھƾ���ȼ����ȼ�������ھƾ���Ŀ����_____��_____��
�����ľƾ����û���������ھƾ���ȼ����ȼ�������ھƾ���Ŀ����_____��_____��