题目内容
【题目】结合下列实验装置,回答:
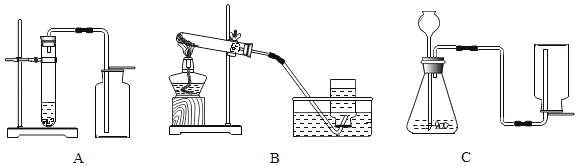
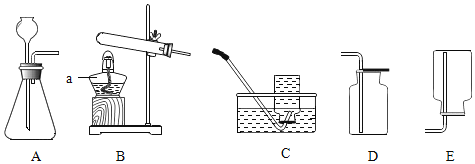
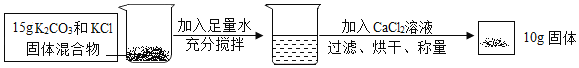
(1)实验室若用分解暗紫色固体制取O2,该固体的名称是_____,可选_____(填字母,下同)装置。若用分解H2O2溶液制取O2,可选_____装置。
(2)探究CO2性质的装置Ⅰ、Ⅱ如下:
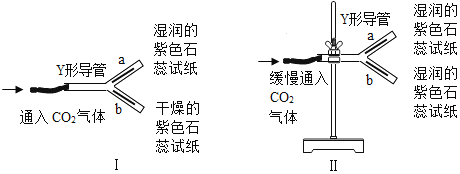
①装置Ⅰ,将Y形导管平放于桌面上,通入CO2后,观察到a管中试纸变红色,
b管中试纸无明显变化,此现象说明CO2能与_____反应,生成的_____使紫色石蕊变红色。
②装置Ⅱ,将Y形导管固定在铁架台上,a管在上方,b管在下方,通入CO2后,观察到b管中试纸先变红色且颜色较深,a管中试纸后变红色且颜色较浅,此现象说明CO2具有①所验证的性质外,还说明CO2的_____。
(3)实验室制取CO2的化学方程式为_____,应选_____(填字母)装置,选择该装置的理由是_____。
【答案】高锰酸钾 B A 水(或H2O) 碳酸(或H2CO3) 密度比空气大 CaCO3+2HCl=CaCl2+H2O+CO2↑ A 此反应属于固液不加热类型,生成的CO2的密度比空气大
【解析】
(1)实验室中常用加热暗紫色的高锰酸钾来制取氧气;属于固体加热型,所以选择装置B来制取,用分解H2O2溶液制取O2,属于固液常温型,且氧气的密度比空气大,应用向上排空气法来收集。故填:高锰酸钾;B;A;
(2)①二氧化碳与水反应生成碳酸,碳酸能使紫色的石蕊试液变红色,所以将Y形导管平放于桌面上,通入CO2后,观察到a管中试纸变红色,b管中试纸无明显变化。故填:水(或H2O);碳酸(或H2CO3);
②装置Ⅱ,将Y形导管固定在铁架台上,a管在上方,b管在下方,通入CO2后,观察到b管中试纸先变红色且颜色较深,a管中试纸后变红色且颜色较浅,此现象说明CO2具有①所验证的性质外,还说明CO2的密度比空气大。故填:密度比空气大;
(3)实验室中常用大理石或石灰石与稀盐酸反应来制取二氧化碳,反应的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;该反应为固液常温型,且生成的二氧化碳的密度比空气大,所以用装置A来制取;故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;A;此反应属于固液不加热类型,生成的CO2的密度比空气大。

【题目】工业上,常采用“盐硝联产工艺”生产高纯度食盐,还可以制得硫酸钠。卤水中主要含有NaCl,还含有少量Na2SO4、CaSO4、MgSO4、CaCl2、MgCl2、FeCl3,用火碱和烟道气中的CO2为原料净化卤水,符合低碳经济发展要求。分析流程,回答问题:
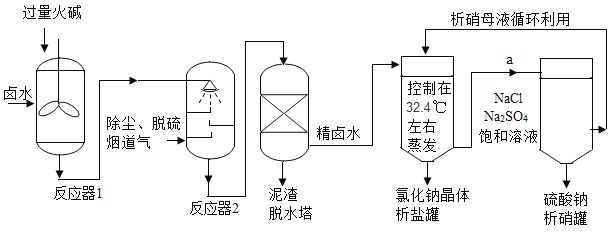
(1)反应器1中主要除去的离子是_____(填符号)。
(2)烟道气通入反应器2前要脱硫,是为了除去有害气体_____ (填化学式)。反应器2中生成沉淀的化学方程式_____ (写一个)。
(3)下表为NaCl和Na2SO4在不同温度时的溶解度:
温度/℃ | 0 | 10 | 20 | 30 | 32.4 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.4 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
4.9 | 9.1 | 19.5 | 40.8 | 52.0 | 48.8 | 46.2 | 45.3 | 44.3 | 43.7 | 42.7 | 42.5 |
从析盐罐中排出的溶液a,在温度不变的条件下,每10g水中含有NaCl约_____g.为提高Na2SO4纯度,析硝罐中析出Na2SO4,需采用_____ (填“升温”或“降温”)结晶方法。
【题目】小明在实验室里进行以下实验:他首先取溶质质量分数为30%、密度为1.15gmL﹣1的较浓盐酸40mL与46g蒸馏水混合配制稀盐酸,再跟石灰石反应制得气体,将此气体通入澄清石灰水,但一直未见浑浊出现。为此,小明请教老师,老师建议他为弄明原因进行实验探究。下面是他探究的过程,请你帮他填答补充完整。
(提出问题)为什么制得的气体不能使石灰水变浑浊?
(猜想假设)猜想一:盐酸浓度仍过大,气体中有挥发出来的氯化氢气体
猜想二:澄清石灰水已经完全变质
(实验探究)
实验操作 | 实验现象 | 实验结论 |
①将所得气体通入稀硝酸和硝酸银的混合溶液中 | ______ | 猜想一正确 化学方程式______ |
②吸取少量所用澄清石灰水于试管中,滴加_____,振荡。 | 溶液变红色 | 猜想二不正确 |
(分析结论)原来所配盐酸浓度达_____,应当将其再进行稀释。
(反思拓展)①小明的实验证明了澄清石灰水没有完全变质,但是并不能说明澄清石灰水没有变质,理由是_____。
②若除掉二氧化碳中混有的少量氯化氢气体,可选择的最佳试剂是_____(填字母序号)。
a氢氧化钠溶液
b水
c饱和的碳酸氢钠溶液
d硝酸银溶液