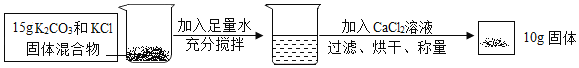
题目内容
【题目】中国的制造业正在史无前例地快速发展着,合金就是其中重要的材料。
(1)黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质(杂质不溶于水,不参与反应)。处理黄铜渣可得到硫酸锌,其主要流程如图所示,操作中加热蒸发后冷却至原温度:
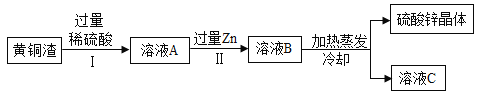
①溶液A中所含溶质为_____(填写化学式);
②下列说法错误的是_____。
A 溶液A的质量小于溶液B
B 溶液C中溶质的质量分数小于溶液B
C 溶液A中ZnSO4的质量大于CuSO4
(2)锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,生成氢气0.2g,将反应后的溶液蒸发水分后得到固体混合物(不含结晶水)的质量为_____g。
【答案】CuSO4、ZnSO4、H2SO4 B 13.4
【解析】
(1)①锌、氧化锌会与硫酸反应生成硫酸锌,氧化铜和硫酸反应生成硫酸铜,所以溶液A中所含溶质为硫酸锌、硫酸铜、硫酸;
②A、在溶液A中加入过量锌得到溶液B,锌和硫酸铜反应生成铜和硫酸锌,和硫酸反应生成氢气和硫酸锌,发生了置换反应,每65份质量的锌进入溶液,从溶液中析出64份质量的铜,每65份质量的锌进入溶液,从溶液中出来2份质量的氢气,故溶液A中的质量小于溶液B,不符合题意;
B、溶液C为饱和溶液,质量分数达到同温度下的最大值,符合题意;
C、因混合物中Zn7%、ZnO31%、Cu50%、CuO5%,氧化锌的相对分子质量、占比均大于氧化铜,另外锌也能和硫酸反应生成硫酸锌,而铜和硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜,不符合题意。故选B。
(2)根据硫酸的化学式H2SO4,其中氢元素与硫酸根的质量比=2:96=1:48,当硫酸中所含氢元素的质量为0.2g时,硫酸根的质量=0.2g÷![]() =9.6g,则得固体硫酸锌、硫酸铝、硫酸镁混合物的质量为:9.6g+3.8g=13.4g。
=9.6g,则得固体硫酸锌、硫酸铝、硫酸镁混合物的质量为:9.6g+3.8g=13.4g。

 举一反三单元同步过关卷系列答案
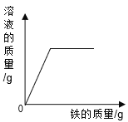
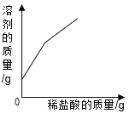
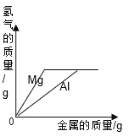
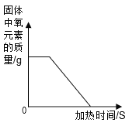
举一反三单元同步过关卷系列答案【题目】下表中有关量的变化图像与其对应叙述相符的是
A | B | C | D |
|
|
|
|
向一定质量的稀硫酸中加入足量的铁 | 向一定质量的氢氧化钠溶液中加入稀盐酸 | 向等质量、等质量分数的稀盐酸中加入足量的镁和铝 | 加热高锰酸钾固体制氧气 |
A. AB. BC. CD. D