题目内容
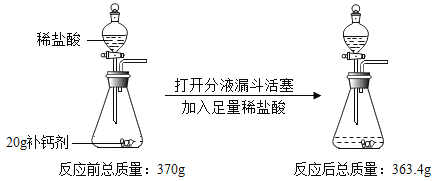
【题目】(1)氯气是一种有毒的黄绿色气体,能溶于水,难溶于饱和食盐水。某课外活动小组利用下列化学反应在实验室中制备并收集纯净、干燥的氯气, MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O 看图回答下列问题:
MnCl2+Cl2+2H2O 看图回答下列问题:
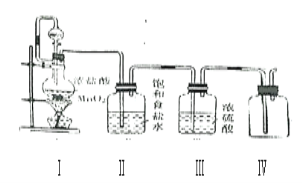
①装置Ⅰ中,分液漏斗与烧瓶之间导管的作用是___
②装置Ⅱ、装置Ⅲ是净化装置,他们的作用分别是______、___
③除了装置Ⅳ可以收集氯气外,还可以用排液法收集,下列液体可以用来收集氯气的是___
A.饱和食盐水 B.水
④用装置Ⅳ收集氯气,还有不妥之处,请你指出来___
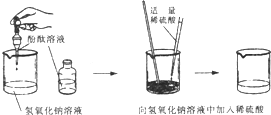
(2)某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。
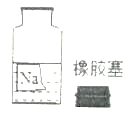
(提出问题)这瓶溶液的溶质是什么?
(获得信息)
①酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
②实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
③氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠;猜想二:碳酸钠;猜想三:碳酸氢钠。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取一支洁净试管,加入待测液,然后滴加过量稀盐酸 | 有______产生 | 该溶液的溶质是碳酸钠或者是______ |
再取一支洁净试管, 加入待测液,后加入过量的氯化钡溶液 | 有白色沉淀产生 | 该溶液的溶质是______,发生反应的化学方程式为___ |
小华认为上面的结论不完全正确,理由是______(用化学方程式表示) ;
小组讨论后,又进行如下实验:
取第二次实验后的上层清液,滴入无色酚酞试液。溶液呈红色。
(实验结论)这瓶溶液的原溶质是氢氧化钠
(交流反思)实验探究中,能否用氢氧化钡溶液替代氯化钡溶液?______(填“能”或“不能”) ;实验中取用液体药品时,应注意密封保存。
【答案】平衡气压,使液体顺利流下 除去 HC1气体; 除去水蒸气 A 氯气有毒,不能直接排放到大气中(或:缺少尾气处理装置) 气体 NaHCO3 Na2CO3 Na2CO3+BaCl2=BaCO3↓+2NaC1 2NaOH+CO2=Na2CO3+H2O 不能
【解析】
(1)①通过分析可知,装置Ⅰ中,分液漏斗与烧瓶之间导管的作用是:平衡气压,使液体顺利流下;
②氯气难溶于饱和食盐水,浓硫酸具有吸水性,所以装置Ⅱ、装置Ⅲ是净化装置的作用分别是:除去氯化氢(HCl)气体、除去水蒸气;
③氯气难溶于饱和食盐水,所以用排液法收集,可以用来收集氯气的是饱和食盐水,故选A;
④氯气是一种有毒气体,所以用装置Ⅳ收集氯气,还有不妥之处是:氯气有毒,不能直接排放到大气中(或缺少尾气处理装置);
(2)实验探究:取一支洁净试管,加入待测液,然后滴加过量稀盐酸,产生气泡,说明溶液中含有碳酸根离子或碳酸氢根离子;
再取一支洁净试管,加入待测液,后加入过量的氯化钡溶液,有白色沉淀产生,是因为碳酸钠和氯化钡反应生成白色沉淀碳酸钡和氯化钠,反应的化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl,实验过程如下所示:
实验步骤 | 实验现象 | 实验结论 |
取一支洁净试管,加入待测液,然后滴加过量稀盐酸 | 有气体产生 | 该溶液的溶质是碳酸钠或者是NaHCO3 |
再取一支洁净试管, 加入待测液,后加入过量的氯化钡溶液 | 有白色沉淀产生 | 该溶液的溶质是碳酸钠,发生反应的化学方程式为BaCl2+Na2CO3═BaCO3↓+2NaCl |
小华认为上面的结论不完全正确,理由是:溶液中的溶质可能是氢氧化钠,氢氧化钠和二氧化碳反应生成了碳酸钠和水,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
交流反思:实验探究中,不能用氢氧化钡溶液替代氯化钡溶液,这是因为碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,影响对氢氧化钠的检验。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案