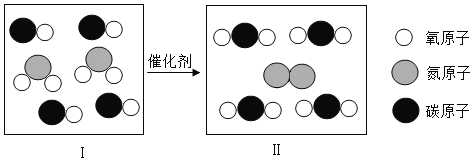
题目内容
【题目】化学实验和化学计算都是化学学习的重要内容.
(一)通过学习,我们已经掌握了一些气体的制备方法,如制取氧气的方法有:
甲.分离液体空气; 乙.加热分解高锰酸钾; 丙.分解过氧化氢; 丁.加热分解氯酸钾等;也初步认识了一些气体的制取和收集装置,例如:

(1)仪器a 的名称是_____.
(2)以上制取氧气的方法中,属于物理方法的是_____;
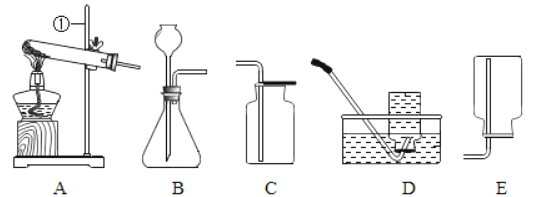
(3)若用方法丙制取氧气,应选用的装置组合为_____(填字母序号)
(二)在现代生活中,人们越来越注重微量元素的摄取.碘元素对人体有着至关重要的作用.
如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明,请回答下列问题:

(1)食用“碘盐”属于_____;(纯净物或混合物)
(2)根据碘盐的食用方法和贮存指南,可推知碘酸钾的化学性质之一是:_____
(3)碘酸钾(KIO3)中钾元素、碘元素的质量比是_____, 碘酸钾(KIO3)中碘元素的质量分数的计算式是_____.
【答案】集气瓶 甲 BC(BE) 混合物 受热易分解 39:127 ![]() ×100%
×100%
【解析】
(一)(1)仪器a 的名称是:集气瓶;
(2)分离液态空气得到氧气属于物理变化,属于物理方法的有:甲;
(3)如果用双氧水和二氧化锰制氧气就不需要加热,应选用的装置组合为BC(BE);
(二)(1)食用“碘盐”中含有氯化钠、碘酸钾,食用“碘盐”属于混合物;
(2)根据碘盐的食用方法和贮存指南,可推知碘酸钾的化学性质之一是:受热易分解;
(3)碘酸钾(KIO3)中钾元素、碘元素的质量比为39:127;碘酸钾(KIO3)中碘元素的质量分数的计算式是:![]() ×100%。
×100%。

【题目】(1)氯气是一种有毒的黄绿色气体,能溶于水,难溶于饱和食盐水。某课外活动小组利用下列化学反应在实验室中制备并收集纯净、干燥的氯气, MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O 看图回答下列问题:
MnCl2+Cl2+2H2O 看图回答下列问题:
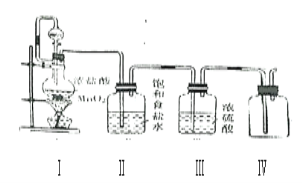
①装置Ⅰ中,分液漏斗与烧瓶之间导管的作用是___
②装置Ⅱ、装置Ⅲ是净化装置,他们的作用分别是______、___
③除了装置Ⅳ可以收集氯气外,还可以用排液法收集,下列液体可以用来收集氯气的是___
A.饱和食盐水 B.水
④用装置Ⅳ收集氯气,还有不妥之处,请你指出来___
(2)某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。
(提出问题)这瓶溶液的溶质是什么?
(获得信息)
①酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
②实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
③氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠;猜想二:碳酸钠;猜想三:碳酸氢钠。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取一支洁净试管,加入待测液,然后滴加过量稀盐酸 | 有______产生 | 该溶液的溶质是碳酸钠或者是______ |
再取一支洁净试管, 加入待测液,后加入过量的氯化钡溶液 | 有白色沉淀产生 | 该溶液的溶质是______,发生反应的化学方程式为___ |
小华认为上面的结论不完全正确,理由是______(用化学方程式表示) ;
小组讨论后,又进行如下实验:
取第二次实验后的上层清液,滴入无色酚酞试液。溶液呈红色。
(实验结论)这瓶溶液的原溶质是氢氧化钠
(交流反思)实验探究中,能否用氢氧化钡溶液替代氯化钡溶液?______(填“能”或“不能”) ;实验中取用液体药品时,应注意密封保存。
【题目】下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
(1)60℃时,氯化钠的溶解度_______硝酸钾的溶解度(填“>”“=”或“<”)。
(2)20℃时,氯化钠饱和溶液中溶质的质量分数为_______(结果保留至0.1%)。
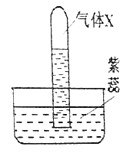
(3)如图所示,观察到U型管中a的液面低于b的液面,澄清石灰水_____________,则在小试管中加入的物质是_____(填字母)。
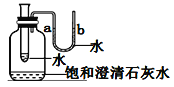
A.浓硫酸 B.氢氧化钠 C.硝酸铵
(4)混有少量氯化钠的硝酸钾固体,加水配成80℃的硝酸钾饱和溶液,再冷却至20℃,析出晶体并得到溶液。下列有关说法中正确的是_______(填字母)。
A.析出的晶体中不一定含有硝酸钾
B.所得溶液一定是硝酸钾饱和溶液
C.上述方法可以将两种物质完全分离