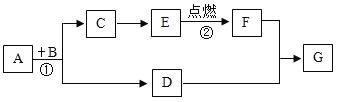
题目内容
【题目】工业酒精中含有少量的甲醇,甲醇有剧毒,不能食用,其分子结构用如图所示的模型表示。下列有关甲醇的叙述中错误的是( )
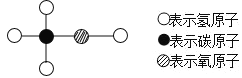
A. 甲醇的化学式为CH4O
B. 甲醇中C、H、O三种元素的质量比为1:4:1
C. 甲醇的相对分子质量为32
D. 甲醇中氧元素的质量分数为50%
【答案】B
【解析】
A、根据甲醇分子结构图,1个甲醇分子是由1个碳原子、4个氢原子和1个氧原子构成的,其化学式为:CH4O,故A说法正确;
B、甲醇中C、H、O三种元素的质量比为12:(1×4):16≠1:4:1,故B说法错误;
C、甲醇的相对分子质量为12+1×4+16=32,故C说法正确;
D、甲醇中氧元素的质量分数为:![]() ×100%=50%,故D说法正确。故选B。
×100%=50%,故D说法正确。故选B。

【题目】(1)氯气是一种有毒的黄绿色气体,能溶于水,难溶于饱和食盐水。某课外活动小组利用下列化学反应在实验室中制备并收集纯净、干燥的氯气, MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O 看图回答下列问题:
MnCl2+Cl2+2H2O 看图回答下列问题:
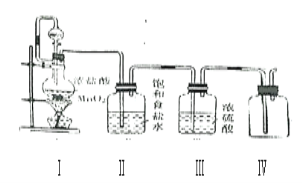
①装置Ⅰ中,分液漏斗与烧瓶之间导管的作用是___
②装置Ⅱ、装置Ⅲ是净化装置,他们的作用分别是______、___
③除了装置Ⅳ可以收集氯气外,还可以用排液法收集,下列液体可以用来收集氯气的是___
A.饱和食盐水 B.水
④用装置Ⅳ收集氯气,还有不妥之处,请你指出来___
(2)某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。
(提出问题)这瓶溶液的溶质是什么?
(获得信息)
①酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
②实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
③氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠;猜想二:碳酸钠;猜想三:碳酸氢钠。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取一支洁净试管,加入待测液,然后滴加过量稀盐酸 | 有______产生 | 该溶液的溶质是碳酸钠或者是______ |
再取一支洁净试管, 加入待测液,后加入过量的氯化钡溶液 | 有白色沉淀产生 | 该溶液的溶质是______,发生反应的化学方程式为___ |
小华认为上面的结论不完全正确,理由是______(用化学方程式表示) ;
小组讨论后,又进行如下实验:
取第二次实验后的上层清液,滴入无色酚酞试液。溶液呈红色。
(实验结论)这瓶溶液的原溶质是氢氧化钠
(交流反思)实验探究中,能否用氢氧化钡溶液替代氯化钡溶液?______(填“能”或“不能”) ;实验中取用液体药品时,应注意密封保存。
【题目】下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
(1)60℃时,氯化钠的溶解度_______硝酸钾的溶解度(填“>”“=”或“<”)。
(2)20℃时,氯化钠饱和溶液中溶质的质量分数为_______(结果保留至0.1%)。
(3)如图所示,观察到U型管中a的液面低于b的液面,澄清石灰水_____________,则在小试管中加入的物质是_____(填字母)。
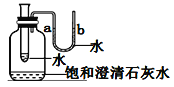
A.浓硫酸 B.氢氧化钠 C.硝酸铵
(4)混有少量氯化钠的硝酸钾固体,加水配成80℃的硝酸钾饱和溶液,再冷却至20℃,析出晶体并得到溶液。下列有关说法中正确的是_______(填字母)。
A.析出的晶体中不一定含有硝酸钾
B.所得溶液一定是硝酸钾饱和溶液
C.上述方法可以将两种物质完全分离
【题目】为了测定混有杂质的石灰石样品中碳酸钙的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 20 | 20 | 17.8 | 15.6 | 13.4 | 13.4 |
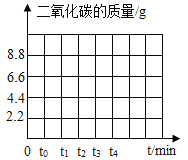
提示:在t0至t1时间段,固体质量不变的原因是刚刚开始加热,尚未达到石灰石分解的温度,反应的化学方程式为:![]() 。
。
(1)反应中产生二氧化碳的质量是_____________。
(2)通过计算求样品中碳酸钙的质量分数_________。(写出计算过程)
(3)请在坐标图中,画出煅烧时生成气体的质量(m气)随反应时间(t)变化的曲线_________