题目内容
【题目】化学反应有的放出热量称为放热反应,有的吸收热量称为吸热反应。化学反应有快有慢,一般增大反应物浓度、接触面积、升高温度、使用催化剂均可加快反应速率
(1)下列过程是化学变化且是放热反应的是(填编号)_____
A 浓硫酸溶于水
B 生石灰加入水中
C NH4NO3 晶体溶于水
D 天然气燃烧
E 制水煤气
(2)实验室用锌粒与 10mL30%的稀 H2SO4反应制取 H2。
①下列措施不能加快反应速率的是(填编号)_______________________。
A 加热
B 将锌粒换成锌粉
C 将 30%的 H2SO4 换成 50%的 H2SO4
D 将 30%的 H2SO4,增加到 20mL
E加入适量 Na2SO4 固体
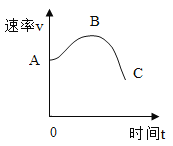
②反应速率v 随时间变化如图所示A→B 速率加快的原因是__________________________;B→C 速率减慢的原因是__________。
(3)实验室用 H2O2 制 O2,为加快反应速率常采取的措施是__________,反应方程式为_____。
(4)已知反应 Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,将一定量 Na2S2O3 溶液、稀 H2SO4 和H2O 同时混合,下列各组实验中最先出现浑浊的是(填编号)______________________。
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O |
A | 20 | 40% 20g | 40% 20g | 10g |
B | 20 | 40% 25g | 40% 20g | 5g |
C | 40 | 80% 10g | 40% 20g | 20g |
D | 40 | 50% 10g | 60% 10g | 5g |
【答案】BD DE 稀硫酸与锌粒反应是放热反应,故发生化学反应时,放出大量的热,溶液温度升高,反应的速率加快。 随着反应的进行,稀硫酸的浓度降低,溶液的反应速率减慢,同时反应放出的热量减少,温度下降,反应的速率进一步减慢。 加入![]() 做催化剂
做催化剂 ![]() D
D
【解析】
影响化学反应的反应速率,主要是增大反应物浓度、接触面积、升高温度、使用催化剂均可加快反应速率,做对比实验,需改变其中的某个因素,其他的量不要改变。
(1)A、浓硫酸溶于水变成稀硫酸,属于物理变化,故不符合题意;
B、生石灰加入水中,是生石灰与水反应生成氢氧化钙,放出大量的热,故符合题意;
C、NH4NO3 晶体溶于水形成NH4NO3溶液,属于物理变化,故不符合题意;
D、天然气燃烧,主要成分![]() 与氧气燃烧生成水和二氧化碳,放出大量的热,故符合题意;
与氧气燃烧生成水和二氧化碳,放出大量的热,故符合题意;
E、制水煤气,是煤与水反应生成一氧化碳和氢气,属于化学变化,但会吸收热量,故不符合题意。
故选BD。
(2)①一般增大反应物浓度、接触面积、升高温度、使用催化剂均可加快反应速率,因此将 30%的 H2SO4,由10 mL增加到 20mL,只增加了反应物的质量,没有改变反应物的浓度,不能加快反应速率;加入适量 Na2SO4 固体,没改变反应物的浓度,不能加快反应速率,故选DE。
②A→B,稀硫酸与锌粒反应是放热反应,故刚开始发生化学反应时,放出热量,溶液温度升高,又使反应的速率加快,曲线上升;B→C,反应物稀硫酸的浓度降低,反应速率下降,放出的热量也少,反应温度开始下降,又使反应速率减小。
(3)实验室用 H2O2 制 O2,在常温下反应非常缓慢,常用![]() 作催化剂,加快反应速率,故化学反应方程式为
作催化剂,加快反应速率,故化学反应方程式为![]() 。
。
(4)化学反应的反应速率,主要是增大反应物浓度、接触面积、升高温度、使用催化剂均可加快反应速率,同时做对比实验,需知道上述几种条件,进行对比,得出结论,最先出现浑浊,即反应速率最快的,溶液的浓度=![]() ,通过表格可知:
,通过表格可知:
A、反应温度20℃,Na2S2O3溶液浓度=![]() =16%,稀H2SO4溶液的浓度=
=16%,稀H2SO4溶液的浓度=![]() =16%;
=16%;
B、反应温度20℃,Na2S2O3溶液浓度=![]() =20%,稀H2SO4溶液的浓度=
=20%,稀H2SO4溶液的浓度=![]() =16%;
=16%;
C、反应温度40℃,Na2S2O3溶液浓度=![]() =16%,稀H2SO4溶液的浓度=
=16%,稀H2SO4溶液的浓度=![]() =16%;
=16%;
D、反应温度40℃,Na2S2O3溶液浓度=![]() =20%,稀H2SO4溶液的浓度=
=20%,稀H2SO4溶液的浓度=![]() =24%;
=24%;
由A和B对比可知,B中Na2S2O3溶液浓度大,故B比A先出现浑浊;由C和D对比可知,D溶液Na2S2O3浓度与稀H2SO4的浓度都大于C,故D比C先出现浑浊;再比较B和D,D的温度大于B的,反应速率快,D中稀硫酸的浓度也大,也使反应速率加快,D组溶液的反应速率最快,先出现浑浊。故选D。