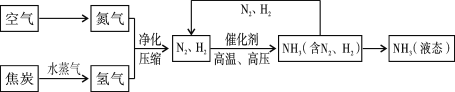
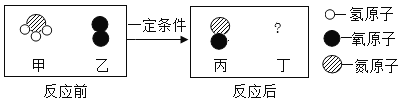
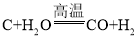题目内容
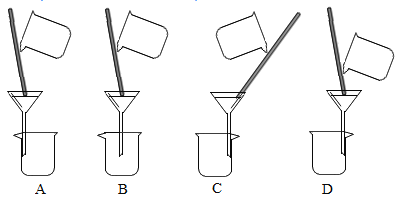
【题目】如图为 CO 还原 CuO“ 微型” 实验装置(夹持仪器等略),已知:HCOOH H2O+CO↑,下列说法错误的是( )
H2O+CO↑,下列说法错误的是( )
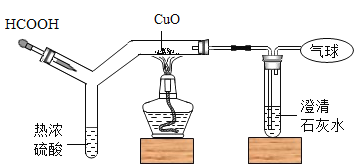
A.实验中所需 CO 可现制现用
B.此装置可节约用品,污染小,现象明显
C.此装置内空间较小,空气易排空,实验危险系数小
D.该实验中的现象为红色粉末变为黑色,澄清石灰水变浑浊
【答案】D
【解析】
A、实验中所需 CO 可通过胶头滴管加入甲酸的方法来制取一氧化碳,可现制现用,故正确;
B、该套装置比较小,节约药品,产生的污染物也较少,现象比较明显,故正确;
C、此装置内空间较小,空气易排空,实验危险系数小,故正确;
D、该实验中的现象一氧化碳还原氧化铜生成了铜和二氧化碳,二氧化碳与氢氧化钙反应生成了碳酸钙和水,现象是黑色粉末变为红色,澄清石灰水变浑浊,故错误。
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。
(1)(查阅资料)氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式______________。
(2)(交流验证)滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为______________。
(3)(提出问题)滤液中溶质的成分是什么?
(4)(猜想假设)猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和________。
猜想四:NaOH、Na2CO3和Ca(OH)2
(5)(讨论分析)经过讨论认为最不合理的是猜想____,原因是______________。
(6)(实验与结论)
实验步骤 | 现象 | 结论 |
步骤I:取少量滤液,向其中加入足量盐酸溶液 | ________ | 猜想二不成立 |
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液 | 产生白色沉淀 | 猜想____成立 |
(7)(拓展延伸)在分析反应后所得物质的成分时,除考虑生成物外,还需考虑___________。
【题目】过氧化氢俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气和水。查阅资料:
①将新制的浓度5%的双氧水加热到65℃时就有氧气产生,加热到80℃时就有较多氧气产生。
②若在相同质量5%的双氧水中加入少量二氧化锰固体,常温下就会立即产生氧气,反应速度快,所需时间短。
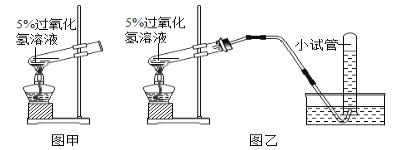
请根据上图回答问题:
(1)请你写出用双氧水和二氧化锰混合物制取氧气的反应文字表达式:____________
(2)小红按图甲装置进行实验,当试管中有大量气泡出现时,伸入带火星的木条,木条并未复燃,为此,他利用图乙装置收集气体,再用带火星的木条检验,木条复燃,那么图甲实验中带火星木条未复燃的原因是__________________。
(3)以下是某小组同学探究影响过氧化氢分解速率部分因素的相关实验数据。
实验序号 | H2O2溶液 浓度% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 5 | 20 | 0.1 | 4 | 16.75 |
② | 15 | V | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
①V=________:从实验_________和__________(填序号)对比可知,过氧化氢分解速率与过氧化氢溶液浓度有关。从表中实验数据对比可知,过氧化氢分解速率与温度的关系是:___
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量__(填“减小”“不变”或“增大”)。
(注意:若正确回答下列问题加4分,总分不超过60分)
③除了上述影响因素外,过氧化氢分解生成氧气的速率还与哪些因素有关?请你继续探究。(写出一种假设,并设计实验方案)
(你的假设)___________
(设计方案)
实验方法及步骤 | 可能观察到的实验现象 | 实验结论 |
_________ | _________ | 假设正确 |