题目内容
【题目】过氧化氢俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气和水。查阅资料:
①将新制的浓度5%的双氧水加热到65℃时就有氧气产生,加热到80℃时就有较多氧气产生。
②若在相同质量5%的双氧水中加入少量二氧化锰固体,常温下就会立即产生氧气,反应速度快,所需时间短。
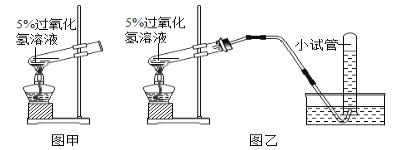
请根据上图回答问题:
(1)请你写出用双氧水和二氧化锰混合物制取氧气的反应文字表达式:____________
(2)小红按图甲装置进行实验,当试管中有大量气泡出现时,伸入带火星的木条,木条并未复燃,为此,他利用图乙装置收集气体,再用带火星的木条检验,木条复燃,那么图甲实验中带火星木条未复燃的原因是__________________。
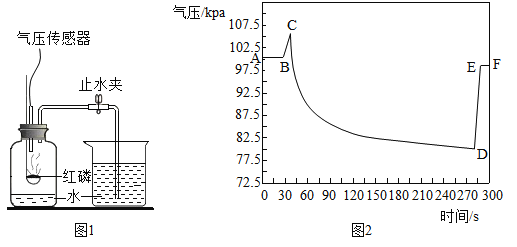
(3)以下是某小组同学探究影响过氧化氢分解速率部分因素的相关实验数据。
实验序号 | H2O2溶液 浓度% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 5 | 20 | 0.1 | 4 | 16.75 |
② | 15 | V | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
①V=________:从实验_________和__________(填序号)对比可知,过氧化氢分解速率与过氧化氢溶液浓度有关。从表中实验数据对比可知,过氧化氢分解速率与温度的关系是:___
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量__(填“减小”“不变”或“增大”)。
(注意:若正确回答下列问题加4分,总分不超过60分)
③除了上述影响因素外,过氧化氢分解生成氧气的速率还与哪些因素有关?请你继续探究。(写出一种假设,并设计实验方案)
(你的假设)___________
(设计方案)
实验方法及步骤 | 可能观察到的实验现象 | 实验结论 |
_________ | _________ | 假设正确 |
【答案】![]() 氧气中含有较多的水蒸气 5 ① ② 其它条件相同时,温度越高反应速率越快 不变 过氧化氢分解生成氧气的速率与催化剂种类有关 相同温度下,取等体积等浓度的过氧化氢溶液分别加入等质量形状相同的不同种类的催化剂,比较收集等体积氧气需要的时间 收集氧气需要的时间不同
氧气中含有较多的水蒸气 5 ① ② 其它条件相同时,温度越高反应速率越快 不变 过氧化氢分解生成氧气的速率与催化剂种类有关 相同温度下,取等体积等浓度的过氧化氢溶液分别加入等质量形状相同的不同种类的催化剂,比较收集等体积氧气需要的时间 收集氧气需要的时间不同
【解析】
过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的文字表达式:![]() 。
。
(2)图甲实验中带火星木条未复燃的原因是氧气中含有较多的水蒸气。
(3)①实验需要控制单一变量为过氧化氢溶液的浓度,过氧化氢溶液体积要一致,故V=5,从实验①和②对比可知,过氧化氢分解速率与过氧化氢溶液浓度有关,即浓度越大,反应速率越快;从表中实验数据对比可知,过氧化氢分解速率与温度的关系是:其它条件相同时,温度越高反应速率越快。
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,溶质的质量不变,产生氧气的总质量不变。
③[你的假设]:过氧化氢分解生成氧气的速率与催化剂种类有关。
[设计方案]
实验方法及步骤:相同温度下,取等体积等浓度的过氧化氢溶液分别加入等质量形状相同的不同种类的催化剂,比较收集等体积氧气需要的时间;
可能观察到的实验现象:收集等体积氧气需要的时间不同,实验过程如下所示:
实验方法及步骤 | 可能观察到的实验现象 | 实验结论 |
相同温度下,取等体积等浓度的过氧化氢溶液分别加入等质量形状相同的不同种类的催化剂,比较收集等体积氧气需要的时间 | 收集等体积氧气需要的时间不同 | 假设正确 |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】空气是一种宝贵的资源。请回答下列问题:
(1)清洁的空气对于人类非常重要,下列做法有利于保护大气的是_______ (填序号,下同)。
a使用清洁能源 b燃放烟花爆竹 c大量植树 d推广私家汽车出行
(2)空气中下列气体过多会引起温室效应的是_______
a二氧化氮 b一氧化碳 c二氧化碳 d二氧化硫
(3)空气污染指数与质量状况的对应关系:
污染指数 | 0-50 | 51-100 | 101-200 | 201-300 | 301以上 |
质量状况 | 优 | 良 | 普通 | 不佳 | 差 |
某市区某天的空气污染指数为48,首要污染物为:可吸入颗粒物。根据以上信息,判断该市区当天的空气质量状况是(____________)
A优 B良 C轻度污染 D重度污染
(4)某化学兴趣小组用红磷测定空气中氧气含量,分6组测定(注:集气瓶容积为100mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积/ml | 20 | 21 | 15 | 20 | 22 | 19 |
根据上述测定,计算空气中氧气体积分数为_________________
【题目】二百多年前,法国化学家拉瓦锡定量的研究了空气的成分。以下两个实验是仿照这个历史上著名实验的原理进行了改进。
(1)图1装置是用红磷燃烧来粗略测定空气中氧气含量。写出集气瓶中物质燃烧的文字(或符号)表达式___________。此实验不仅可以测定氧气占空气的体积分数,还可以说明氮气具有的化学性质是________(只需写一点)。
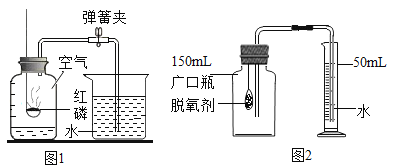
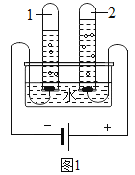
(2)食品脱氧剂(以铁粉为主的物质组成)能通过化学反150mL应除去密闭包装袋中的氧气,使食品处于无氧状态。张山同学用图2装置进行测定空气中氧气含量的实验。下表是张山同学在实验过程中记录的有关数据:
所需要的时间 | 0 | 5 | 10 | 30 | 35 | 45 |
量筒中液面的刻度 | 50 | 35 | 27.5 | 19.7 | 19.7 | 19.7 |
①脱氧剂发生复杂的化学反应,首先是铁粉与氧气、水反应生成氢氧化亚铁(Fe(OH)2)固体,写出该反应文字(或符号)表达式:______________。该反应属于________反应(填基本反应类型)。
②实验过程中观察到量筒中的液面不断下降,水被吸入广口瓶中,出现该现象的原因是____。
③分析表中数据得知,至少经过____分钟后,量简中的液面不再下降。根据表中实验数据进行推算,广口瓶中氧气的体积分数是________(结果精确到0.1%)。
④小虎同学的实验用时45分钟,结果发现广口瓶中收集到的水约为张山同学的1/3,请你着小虎同学找出造成实验失误的可能原因之一:__________。
⑤与燃烧红磷相比,用脱氧剂测定空气中氧气含量的优点是__________。
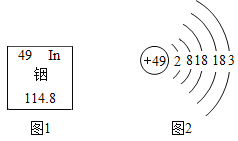
【题目】下表是元素周期表的部分信息,请回答下列问题:
1H 氢 | 2He 氦 | |||||||
3Li 锂 | 4Be 铍 | 5B 硼 | 6C 碳 | 7N 氮 | 8O 氧 | 9F 氟 | 10Ne 氖 | |
llNa 钠 | 12Mg 镁 | 13A1 铝 | 14Si 硅 | 15P 磷 | 16S 硫 | 17C1 氯 | 18Ar 氩 | |
19K 钾 | xCa 钙 | …… | ||||||
(1)地壳中含量最多的元素的原子序数是___________地壳中含量最多的金属元素是______ ,它和含量最多的非金属元素组成的化合物化学式___________,相对分子质量___________。
(2)分析上表可发现:每一横行元素从左向右排列所遵循的一条规律是____________。根据此规律,可知图中x = _________ ,它的离子符号是______,氧化物化学式为_______
(3)15号元素的原子结构示意图_____________ 。