题目内容
【题目】某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。
(1)(查阅资料)氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式______________。
(2)(交流验证)滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为______________。
(3)(提出问题)滤液中溶质的成分是什么?
(4)(猜想假设)猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和________。
猜想四:NaOH、Na2CO3和Ca(OH)2
(5)(讨论分析)经过讨论认为最不合理的是猜想____,原因是______________。
(6)(实验与结论)
实验步骤 | 现象 | 结论 |
步骤I:取少量滤液,向其中加入足量盐酸溶液 | ________ | 猜想二不成立 |
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液 | 产生白色沉淀 | 猜想____成立 |
(7)(拓展延伸)在分析反应后所得物质的成分时,除考虑生成物外,还需考虑___________。
【答案】![]()
![]() Ca(OH)2 四
Ca(OH)2 四 ![]() (或“氢氧化钙能与碳酸钠能反应生成了碳酸钙沉淀和氢氧化钠”) 没有气泡产生 三 反应物是否过量
(或“氢氧化钙能与碳酸钠能反应生成了碳酸钙沉淀和氢氧化钠”) 没有气泡产生 三 反应物是否过量
【解析】
根据信息:氢化钙在常温下能与水反应生成氢氧化钙和氢气,及碳酸钙和盐酸反应的方程式书写;利用氢氧化钙能与碳酸钠能反应生成了碳酸钙沉淀和氢氧化钠,反应后溶液中溶质的成分除了生成物氢氧化钠外,还要考虑碳酸钠、氢氧化钙是否过量的问题进行分析作答。
(1)氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式![]() ;
;
(2)滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为![]() ;
;
(4)猜想一:氢氧化钙和碳酸钠恰好完全反应时溶质是NaOH;
猜想二:碳酸钠过量时溶质是NaOH和Na2CO3;
猜想三:氢氧化钙过量时溶质是NaOH、Ca(OH)2;
猜想四:碳酸钠、氢氧化钙都过量溶质是NaOH、Na2CO3、Ca(OH)2;
(5)经过分析,大家一致认为上述猜想四不需要验证,肯定是错误的,由于氢氧化钙能与碳酸钠能反应生成了碳酸钙沉淀和氢氧化钠,反应的化学方程式是:![]() ;
;
(6)步骤I:取少量滤液,向其中加入足量盐酸溶液,由于猜想二不成立,即没有碳酸钠,所以现象是没有气泡产生;
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液,产生白色沉淀,说明氢氧化钙能与碳酸钠能反应生成了碳酸钙沉淀,所以证明溶质有氢氧化钙,猜想三成立;
(7)【拓展延伸】在分析反应后所得物质的成分时,除考虑生成物外,还需考虑反应物是否过量。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】金属防腐是科学研究中的重大课题。某校学习小组以铁的腐蚀为项目进行如下研究。
(认识铁的腐蚀)
(1)下列环境中的铁制品最容易生锈的是_______(填字母序号)。
A 未擦干的铁锅 B 除油漆的栏杆 C 盛水的不锈钢水杯
(2)铁锈的主要成分是Fe2O3·xH2O,其中铁元素的化合价是____。
(探究铁的腐蚀)
(3)该小组用下图甲装置进行实验,起始时量筒内水面处于50 mL刻度处,之后水面缓慢上升。几天后水面最终处于约____(填“40”或“10”)mL刻度处,原因是____。
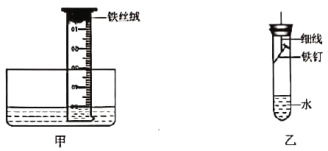
(拓展探究)
(4)小强同学进行如下实验:取铁钉用砂纸打磨,称其质量,按上图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
铁钉质量增加/g | 0.02 | 0.04 | 0.08 | 0.16 | 0.18 | 0.18 | 0.18 |
小强同学的实验是探究____因素对铁钉腐蚀快慢的影响,结论是____。
(5)有同学认为小强的实验未能真实反映50℃以后铁钉腐蚀的快慢,理由是50℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:____;改进实验方案证明你的____。