题目内容
【题目】某学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率。于是,他们对此展开探究:
(提出问题)什么物质是该反应的催化剂?
(猜想与假设)
假设一:小芳同学:铁钉表面的氧化铁是![]() 溶液分解反应的催化剂。
溶液分解反应的催化剂。
假设二:小华同学:铁钉里的铁是![]() 溶液分解反应的催化剂。
溶液分解反应的催化剂。
(实验与结论)
实验操作 | 实验现象 | 实验结论 |
实验Ⅰ:把一定质量的氧化铁粉末加入到装有 | ①________ | 假设一成立 |
实验Ⅱ:取 | 无现象 | 假设二③________(填“成立”或“不成立”) |
(反思与交流)(1)同学们讨论后认为,小芳的“实验Ⅰ”还不能确切说明氧化铁就是过氧化氢分解制取氧气的催化剂,理由是:④________;请你设计实验(写出实验操作、现象及结论)证明其中的某一点理由:⑤________。
(2)小强观察发现“实验Ⅱ”中一直没有现象的试管,过了一段时间后试管中也出现了气体,小强觉得奇怪。你猜想其中的原因是:⑥________。
(拓展提升)贝壳的主要成分是碳酸钙![]() ,请回答以下问题:
,请回答以下问题:
(1)碳酸钙中碳、氧两种元素的质量比为________。
(2)若实验测得某贝壳中碳酸钙的质量分数为![]() ,则
,则![]() 该贝壳中含有的钙元素质量相当于多少
该贝壳中含有的钙元素质量相当于多少![]() 生石灰
生石灰![]() 中含有的钙元素的质量。(写出计算过程)_______g
中含有的钙元素的质量。(写出计算过程)_______g
【答案】带火星的木条复燃 铁粉 不成立 有可能是氧化铁与双氧水反应产生氧气,要说明氧化铁是催化剂,还要证明氧化铁的质量和化学性质在反应前后没有改变 实验操作:待实验I中不再产生气泡时,再向管中加入过氧化氢溶液;
实验现象:溶液中又产生气泡;
实验结论:氧化铁的化学性质在反应前后没有改变。
或者实验操作:把1g的氧化铁粉末加入到装有10mL5%的过氧化氢溶液的试管中,待充分反应不再产生气泡后,分离出固体粉末,充分干燥后,称量固体的质量;
实验现象:反应后氧化铁粉末的质量为1g;
实验结论:氧化铁的质量在反应前后没有改变。 可能铁单质被过氧化氢氧化变成氧化铁,然后氧化铁催化过氧化氢溶液分解 1:4 设生石灰的质量为x,则有:
![]()
解得x=44.8g
答:100g该贝壳中含有的钙元素质量相当于44.8g生石灰中含有的钙元素的质量。
【解析】
将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率。对此展开探究:
提出问题:什么物质是该反应的催化剂?
猜想与假设:
假设一:小芳同学:铁钉表面的氧化铁是![]() 溶液分解反应的催化剂。
溶液分解反应的催化剂。
假设二:小华同学:铁钉里的铁是![]() 溶液分解反应的催化剂。
溶液分解反应的催化剂。
实验与结论:
实验操作
Ⅰ:把一定质量的氧化铁粉末加入到装有10mL5%的过氧化氢溶液的试管中,并用一根带火星的小木条置于试管口,观察现象。
根据实验结论:假设一成立,即氧化铁是![]() 溶液分解反应的催化剂;
溶液分解反应的催化剂;
可推测实验现象为:带火星的木条复燃
Ⅱ:取10mL5%的过氧化氢溶液于另一支试管中,加入铁粉,并用一根带火星的小木条置于试管口,观察现象。
根据实验无现象,得出实验结论:假设二不成立。
反思与交流:
(1)同学们讨论后认为,小芳的“实验Ⅰ”还不能确切说明氧化铁就是过氧化氢分解制取氧气的催化剂,理由是:有可能是氧化铁与双氧水反应产生氧气,要说明氧化铁是催化剂,还要证明氧化铁的质量和化学性质在反应前后没有改变;
可设计如下实验验证氧化铁的化学性质没有改变:
实验操作:待实验I中不再产生气泡时,再向管中加入过氧化氢溶液;
实验现象:溶液中又产生气泡;
实验结论:氧化铁的化学性质在反应前后没有改变。
可设计如下实验验证氧化铁的质量没有改变:
实验操作:把1g的氧化铁粉末加入到装有10mL5%的过氧化氢溶液的试管中,待充分反应不再产生气泡后,分离出固体粉末,充分干燥后,称量固体的质量;
实验现象:反应后氧化铁粉末的质量为1g;
实验结论:氧化铁的质量在反应前后没有改变。
(2)小强观察发现“实验Ⅱ”中一直没有现象的试管,过了一段时间后试管中也出现了气体,小强觉得奇怪。猜想其中的原因可能是铁单质被过氧化氢氧化变成氧化铁,然后氧化铁催化过氧化氢溶液分解。
拓展提升:
碳酸钙的化学式为![]() ,则有:
,则有:
(1)碳酸钙中碳、氧两种元素的质量比为![]() 。
。
(2)设生石灰的质量为x,则有:
![]()
解得x=44.8g
答:100g该贝壳中含有的钙元素质量相当于44.8g生石灰中含有的钙元素的质量。

【题目】氯化钠与硝酸钠的溶解度曲线如图:
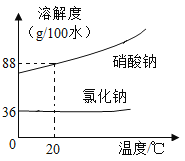
(1)20℃时溶解度较小的物质是______。
(2)从硝酸钠和氯化钠的混合溶液中提纯硝酸钠的方法是_____,可以利用该方法提纯硝酸钠的理由是_____。
Ⅰ.固体混合物中硝酸钠的含量较高,氯化钠的含量较低
Ⅱ.硝酸钠的溶解度受温度影响变化较大
Ⅲ.0℃至100℃,硝酸钠的溶解度始终大于氯化钠
(3)海水中有氯化钠,我们可以利用海水晒盐。某地海水中主要物质的含量见表。
物质 | 每100g海水所含质量(g) |
水 | 96.5 |
氯化钠 | 2.7 |
硫酸钠 | 0.2 |
…… |
①该海水中氯化钠的质量分数为_____。
②20℃时的100g该海水,当水的蒸发量大于____g时,开始析出氯化钠。