题目内容
【题目】现有Fe﹣Ag、Fe﹣Cu、Fe﹣Al、Fe﹣Zn四种铁的合金,取其中一种合金样品5.6g,跟足量稀硫酸反应,得到0.3g H2,则此合金样品可能是( )
A. Fe﹣Ag合金B. Fe﹣Cu合金C. Fe﹣Al合金D. Fe﹣Zn合金
【答案】C
【解析】
铜、银不能和稀硫酸反应;
设5.6g铁与足量的稀硫酸充分反应生成氢气的质量为X,

解得:X=0.2g;
设5.6g锌与足量的稀硫酸充分反应生成氢气的质量为Y,
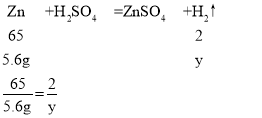
解得:Y=0.17g,
设5.6g铝与足量的稀硫酸充分反应生成氢气的质量为Z,

解得:Z=0.62g,
由以上计算可知,
A、5.6gFe﹣Ag合金与足量的稀硫酸充分反应,产生氢气的质量只能小于0.2g,故A不符合题意;
B、5.6gFe﹣Cu合金与足量的稀硫酸充分反应,产生氢气的质量只能小于0.2g,故B不符合题意;
C、5.6gFe﹣Al合金与足量的稀硫酸充分反应,产生氢气的质量只能大于0.2g小于0.62g,在其中包含0.3g,故C符合题意。
D、5.6gFe﹣Zn合金与足量的稀硫酸充分反应,产生氢气的质量只能大于0.17g小于0.2g,故D不符合题意;
故选:C。

练习册系列答案
相关题目